Бактерии вызывающие пародонтит: Ученые установили связь между бактериями, которые вызывают пародонтоз и болезнью Альцгеймера | Громадское телевидение
Ученые установили связь между бактериями, которые вызывают пародонтоз и болезнью Альцгеймера | Громадское телевидение
Бактерии Porphyromonas gingivalis, которые размножаются в полости рта и вызывают болезни десен, могут играть важную роль в возникновении болезни Альцгеймера. Об этом говорится в статье в журнале Science Advances, пишет издание «N + 1». Авторы статьи обнаружили корреляцию между появлением этой бактерии и симптомами нейродегенеративного заболевания, и экспериментально показали эту связь на мышах.
Porphyromonas gingivalis — грамманаэробная бактерия, которая вызывает пародонтоз. После попадания в организм она распространяется в крови, может попадать в коронарные артерии, плаценту и печень.
Главная опасность этой бактерии заключается в синтезе гингинпаинов — это ферменты-протеазы, которые режут связи между аминокислотами в белках. Гингинпаины распространяются за пределы материнской клетки и доставляются к клеткам хозяина в виде пузырьков.
Стефан Домини из компании Cortexyme и Ян Потемпа из Ягеллонского университета в Польше, а также другие ученые решили проверить влияние гингинпаинов на деградацию нервной ткани и может ли оно провоцировать развитие болезни Альцгеймера.
Первое, что проверили ученые — действительно ли есть корреляция между присутствием гингинпаинов и нейродегенеративными заболеваниями. Для этого они исследовали ткани мозга людей, страдающих болезнью Альцгеймера, и проверили их на наличие бактериальных ферментов-протеаз. Более 90% из 50 образцов содержали различные типы гингипаинов.
«Исследователям удалось обнаружить взаимосвязь между появлением в клетках этих ферментов и повреждением тау-белков. Опыт проводился на колонии человеческих клеток», — говорится в сообщении.
Также исследователи провели серию экспериментов на лабораторных мышах. В одной группе были животные, которых заражали P.gingivalis воздушно-капельным путем, во второй — были самки, зараженные бактерией прямо в мозг.
Затем нервная ткань мышей красилась и проводился иммуногистохимический анализ.
Исследователи проверили мозг мышей, зараженных воздушно-капельным путем, и обнаружили в нем присутствие P.gingivalis. Для этого использовали метод полимеразно-цепной реакции.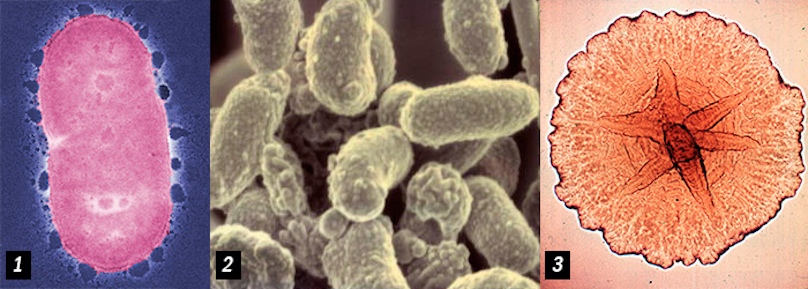
Результаты исследования подтвердили связь между заражением бактерией P.gingivalis и проявлениями болезни Альцгеймера, отмечается в материале.
В статье также говорится о том, что лечение антибиотиками не убивает Porphyromonas gingivalis, а только вырабатывает устойчивость бактерии к лекарственным средствам.
Ранее исследование показало, что у многодетных матерей на 70% чаще развивается болезнь Альцгеймера.
Пародонтит — болезнь цивилизации
Согласно данным ВОЗ, распространенность пародонтита составляет 98%. То есть воспаление пародонта — тканей, окружающих зуб, отмечается почти у всех людей планеты.
К счастью, в настоящий момент мнение ученых всего мира единодушно: пародонтит – это инфекционное заболевание. Бактерии, обитающие под десной и вызывающие ее воспаление, приводят не только к потере зубов. Согласно последним научным данным, патогенные микробы из полости рта попадают в кровоток и с каждым ударом сердца разносятся по всему организму, оседая на стенках сосудов, клапанах сердца, суставах, а значит во всех органах. Эти бактерии проникают и через плаценту, нанося огромный, иногда непоправимый, вред плоду.
Эти бактерии проникают и через плаценту, нанося огромный, иногда непоправимый, вред плоду.
В настоящее время в мире известно более 50 соматических заболеваний, четко связанных с воздействием микробов, вызывающих пародонтит. Сняв воспаление при пародонтите, можно предотвратить или облегчить страдания из-за соматических заболеваний. И это не какие-то легкие болезни, а самые тяжелые, от которых умирают люди разного возраста и даже только что родившиеся дети: сердечно-сосудистые, рак, сахарный диабет, болезни суставов, Альцгеймера, Паркинсона, менингит, сепсис… Помните! Более 50 заболеваний.
Согласно последним данным ВОЗ, 92% людей во всем мире не умеют чистить зубы, 50% тех, кто их чистит, затрачивают на это всего 46 секунд, вместо 2,5-3 минут, позволяющих удалить патогенные бактерии. К счастью стоматологов и всех людей, патогенные микробы при пародонтите находятся не внутри организма, а в полости рта, где их может увидеть каждый человек, окрасив микробный налет. А увидев, уничтожить их собственными руками, научившись правильно чистить зубы.
Но мы, люди – существа разумные (?!) делаем вид, что все в порядке и изощренно заливаем полость рта и тело всевозможными дезодорантами и ополаскивателями, выращиваем патогенную инфекцию, убивая полезных микробов, усиленно защищающих нас. Не верите? Посмотрите рекламу этих средств на всех каналах телевидения. Задумайтесь! Опомнитесь!
Новые научные факты таковы: на ополаскиватели, аэрозоли для полости рта и пасты с антибиотиками и антисептиками для ежедневного использования наложено табу! Их может назначать по строгим показаниям и на небольшой срок только врач.
Но людям об этом никто не говорит. Производители всеми средствами призывают и взрослых, и детей пользоваться этими средствами.
Как и в далекие времена, люди продолжают уничтожать неприятный запах, появляющийся от действий патогенных бактерий, не зная об их огромном вреде здоровью. В период Ренессанса богатые люди в огромном количестве пользовались духами, чтобы скрыть запах грязного тела, поскольку мылись тогда редко.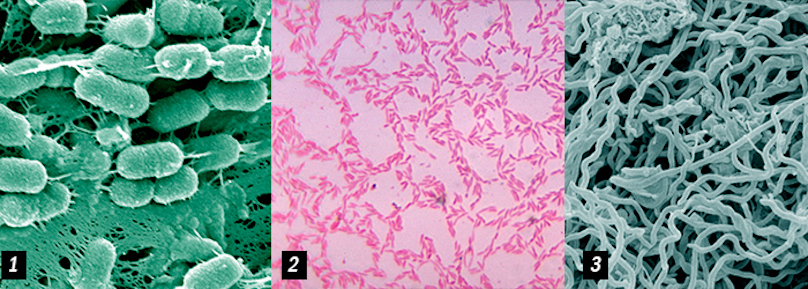
Эффективное лечение пародонтита без боли и операций – ПЕРИОДЕНТ
“Заболевания пародонта, такие как пародонтит и гингивит, – самые распространённые заболевания в Мире” (Книга Рекордов Гиннеса).Что такое пародонтит?
Современные представления о причинах и лечении пародонтита
Согласно официальной классификации и определению Всемирной Организации Здравоохранения, пародонтит – это инфекционное воспаление пародонта (совокупности тканей, удерживающих зуб). Были выявлены несколько семейств патогенных бактерий, вызывающих пародонтит в хронической или острой форме (т.н. “
Общим свойством семейств патогенных анаэробных бактерий является также высокая устойчивость к антибиотикам и, в отличие от “нормальной” флоры, – эти бактерии питаются тканями пародонта. Некоторые из этих бактерий способны даже “обманывать” нашу иммунную систему и вызывать аутоиммунные реакции, заставляя организм “нападать” на здоровые клетки пародонта для того, чтобы самим питаться продуктами распада погибших тканей вокруг зуба.
Некоторые из этих бактерий способны даже “обманывать” нашу иммунную систему и вызывать аутоиммунные реакции, заставляя организм “нападать” на здоровые клетки пародонта для того, чтобы самим питаться продуктами распада погибших тканей вокруг зуба.
Высокая, почти абсолютная устойчивость к лекарствам у патогенных бактерий, вызывающих пародонтит, объясняется их способностью выделять внешнюю биопленку (пресловутый зубной налёт), которая повышает устойчивость к средствам в тысячи раз (!). А также доказан обмен генами устойчивости между разными бактерия. Всё это делает пародонтальную инфекцию чуть ли неизлечимым заболеванием. Однако, это не так, современная пародонтология уже знает и успешно применяет эффективные методы лечения пародонтита.
Выявлена и доказана прямое влияние пародонтита на весь организм в целом. В настоящее время доказано например, что риск инфаркта миокарда повышается в 7 раз, угроза выкидыша также резко возрастает.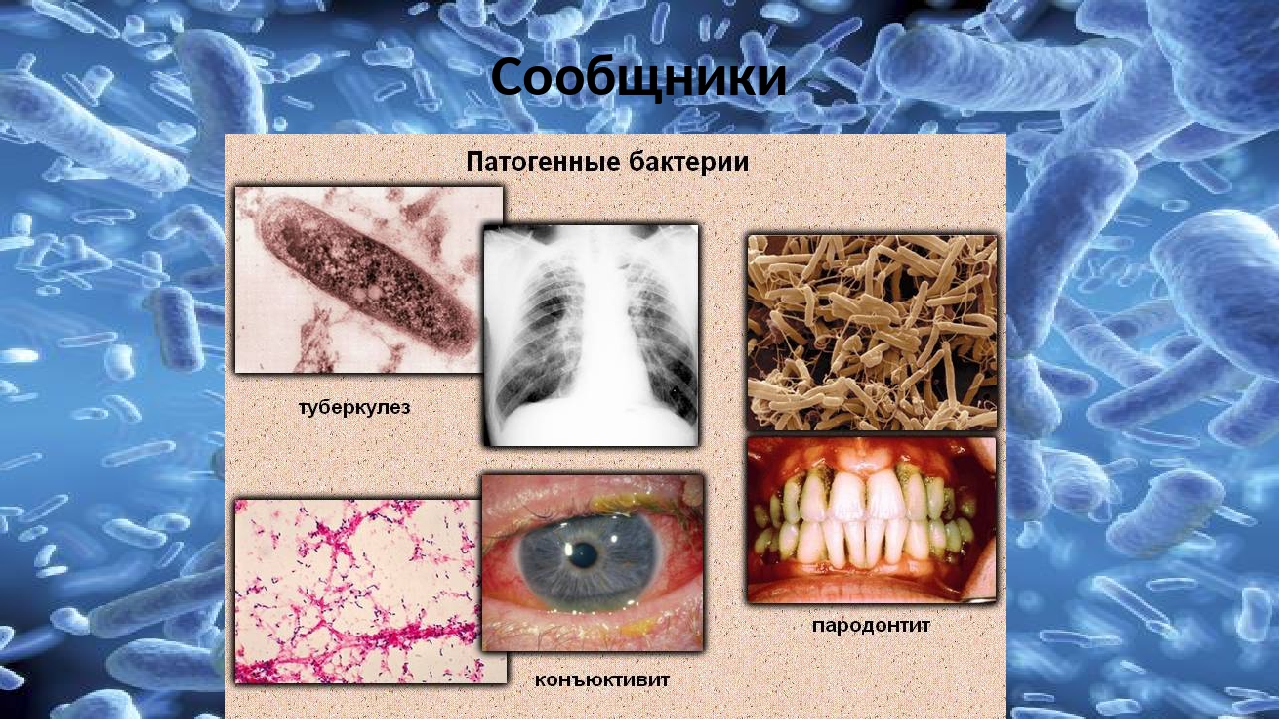 Несмотря на невероятность таких открытий, это доказано и совершенно логично, если понимать природу и причину возникновения пародонтита. Дело в том, что бактерии и их споры циркулируют с кровотоком по всему организму. В бляшках сосудов миокарда находят те же бактерии, которые вызвали пародонтит у данного пациента. Риск выкидыша объясняется способностью некоторых “пародонтитных” бактерий вызывать аутоиммунные реакции, перепрограммировать работу нашего клеточного иммунитета, провоцируя тем самым выкидыш!
Несмотря на невероятность таких открытий, это доказано и совершенно логично, если понимать природу и причину возникновения пародонтита. Дело в том, что бактерии и их споры циркулируют с кровотоком по всему организму. В бляшках сосудов миокарда находят те же бактерии, которые вызвали пародонтит у данного пациента. Риск выкидыша объясняется способностью некоторых “пародонтитных” бактерий вызывать аутоиммунные реакции, перепрограммировать работу нашего клеточного иммунитета, провоцируя тем самым выкидыш!
Ниже представлены несколько наиболее опасных и распространенных семейств бактерий, вызывающие острый (агрессивный) и хронический пародонтит.
Porphyromonas gingivalis (1 & 2) Actinobacillus actinomycetemcomitans (3)
P. intermedia (1), Bacteroides forsythus (2), Treponema denticola (3), T. socranskii
Современные методы эффективного лечения пародонтита.
Способность анаэробных бактерий жить и размножаться без доступа кислорода является также их главным слабым местом. Имея почти абсолютную устойчивость к антибиотикам (т.н. резистентность), данные бактерии абсолютно неустойчивы к такому сильному окислителю, как
Современные методы лечения пародонтита сводятся к разрушению защитной для бактерий биоплёнки и доставке атомарного кислорода непосредственно в контакт с анаэробными “пародонтитными” бактериями. Данный механизм показал абсолютную эффективность, достаточно мгновенного контакта для 100% дезинфекции.
озонирование поддесневого пространства
Озон это неустойчивое соединение, которое выделяет атомарный кислород, который нам нужен для дезинфекции пародонта. С помощью специального прибора озон доносится напрямую под десну, и происходит практически мгновенная гибель бактерий, грибков и вирусов. Процедура довольно быстрая, так требуется всего пара мгновений для контакта с инфекцией и абсолютно безболезненный. Метод получает всё более широкое распространение, существует несколько подобных аппаратов в том числе в России.
С помощью специального прибора озон доносится напрямую под десну, и происходит практически мгновенная гибель бактерий, грибков и вирусов. Процедура довольно быстрая, так требуется всего пара мгновений для контакта с инфекцией и абсолютно безболезненный. Метод получает всё более широкое распространение, существует несколько подобных аппаратов в том числе в России.
фотодинамическая терапия пародонтита
Данный метод основан на применении т.н. фотодинамического реагента, который избирательно прикрепляется к стенке патогенной бактерии, далее под воздействием света определенной длины волны этот реагент выделает атомарный кислород, который мгновнно убивает микроб.
Оба метода не являются инвазивными, могут осуществляться без операции, боли и разрезов десны!
Узнайте больше о наших услугах, задайте вопрос специалисту или запишитесь на бесплатную консультацию:
Современные методы лечения пародонтита — статья | «Триумф Элит»
Пародонтит – точка приложения науки пародонтологии, одного из разделов стоматологии. Занимается изучением природы воспалительных процессов в тканях пародонта (десна, костная ткань), профилактикой и разработкой концепции лечения.
Занимается изучением природы воспалительных процессов в тканях пародонта (десна, костная ткань), профилактикой и разработкой концепции лечения.
Внешне пародонтит проявляется в виде кровоточивости десен, шаткости и смещения зубов. Возможно – налет на зубах и вязкая слюна. Пародонтология объясняет клинические проявления, как деструкцию (разрушение) зубных ячеек в альвеолярных отростках. Если разрушение идет быстро, а лечение – запаздывает, то зубы могут выпасть.
При обострении пародонтита возможно воспаление десен с явными болевыми ощущениями, гнойные выделения, неприятный запах, появление свищей и увеличение лимфатических подчелюстных (под подбородком) узлов.
Перед тем, как писать про методы лечения пародонтита, разумно описать причины зарождения процесса разрушения тканей десен.
Причины появления пародонтита
Современная стоматология выделяет несколько разноплановых причин, которые могут привести к воспалению десен:
- Микроорганизмы, которые концентрируются в районе зубной бляшки.
 Самые распространенные бактерии Actinobacillus actinomycetemcomitans. Но могут быть и Prevotella intermedia, Treponema denticola.
Самые распространенные бактерии Actinobacillus actinomycetemcomitans. Но могут быть и Prevotella intermedia, Treponema denticola. - Травматизм десен. Например, аномалии прикуса, неправильно выстроенный зубной ряд, гипертонус мышц, обеспечивающих процесс жевания.
- Неудовлетворительное состояние организма. Например, сахарный диабет, заболевания кровеносной системы, хронические заболевания почек, болезнь Альцгеймера, иммунодефициты разных видов могут стать причиной развития пародонтита.
- Слабая гигиена полости рта, курение, которые провоцируют образование на зубах био-пленки, в которой поселяются бактерии, которые вызывают воспаление пародонта.
Современные методы лечения пародонтита
Понятно, что лечение пародонтита прямо зависит от причины его появления, уровня поражения тканей десен, уровня физического состояния пациента. Перед началом лечения пациенту объясняют принципы личной гигиены ротовой полости.
Чтобы выявить пародонтит до того, как начнется тотальное разрушение тканей, современная стоматология использует осмотр, рентгенографию, зондирование зубодесневых карманов, опрос пациента относительно предрасположенности его организма к деструктивным изменениям тканей пародонта.
- Классический кюретаж. Предполагается механическая очистка карманов десен от биопленки, бляшек, зубного камня. Может быть закрытым и открытым. При этом происходят потери костной ткани.
- Регенерация поврежденной костной ткани. Рекомендована для однокорневых зубов.
- Резекция ( иссечение) поврежденных костных стенок. Минус – потеря эстетики зубного ряда.
- Удаления инфицированного и поврежденного зуба с последующей установкой имплантов. Минус – значительно поврежденные ткани пародонта не дают качественно установить имплант.
- Снятие бактерицидного налета с зубов при помощи ультразвуковых осциллирующих инструментов. Очистка производится ультразвуковыми колебаниями низкой и средней частоты. Низкие частоты способствуют быстрому очищению. Средние частоты стимулируют появление капилляров и фибробластов в зоне разрушения зубных ячеек, способствуют образованию грануляционной ткани. В общем, ультразвук способствует глубокому проникновению в ткани пародонта лечебных растворов.
 Еще один плюс – минимальное воздействие и “снятие” тканей зубов в сравнении с традиционным, механическим, ротационным способом очищения.
Еще один плюс – минимальное воздействие и “снятие” тканей зубов в сравнении с традиционным, механическим, ротационным способом очищения.
После окончания лечения пациенту рекомендуется целый комплекс мер, которые предотвратят повторное развитие разрушения пародонта. На первое место пародонтология ставит содержание ротовой полости в идеальном состоянии с точки зрения гигиены. Кроме того, необходимость введения в рацион растительной пищи – жесткой, волокнистой. Вмест с этим следует следить за участием в жевании всех зубов. А также своевременно посещать стоматологию, чтобы обеспечить своим зубам регулярное удаление отложений и их пломбирование.
Дареному коню в дёсны не смотрят
Почти каждого родители приучали с детства: «Встал с утра — почисти зубы». Все слышали про кариес и знают, что гигиена полости рта может снизить частоту посещения стоматолога. Но недавно ученые с удивлением узнали, что благодаря этой гигиене можно защититься не только от кариеса, но и от куда более страшных, системных заболеваний. Мы решили разобраться, кто такие инфламмофилы, как возникает пародонтит и каким образом он связан с атеросклерозом, диабетом и другими страшными заболеваниями. Теперь мы можем рассказать вам самое интересное.
Мы решили разобраться, кто такие инфламмофилы, как возникает пародонтит и каким образом он связан с атеросклерозом, диабетом и другими страшными заболеваниями. Теперь мы можем рассказать вам самое интересное.
Партнер цикла — компания SPLAT: ведущий разработчик и производитель профессиональных средств ухода за полостью рта.
О необходимости ухода за ротовой полостью знает каждый с детства, и, казалось бы, это не та область науки, где читатель ждет захватывающих новостей. Однако ошибочно думать, что исследования по здоровью зубов и десен не ведутся. Как выяснила «Биомолекула», дела обстоят совсем по-другому. Ведется переклассификация некоторых заболеваний. Болезни ротовой полости оказываются связаны с такими «раскрученными» темами как диабет, сердечно-сосудистые заболевания и даже рак. Ведутся споры о том, какие компоненты должны входить в состав зубных паст. Разрабатываются пре- и пробиотики для нормализации состава микробиоты ротовой полости. Наконец, даже в обычной жизни пользователь сталкивается с огромным арсеналом средств по уходу за ротовой полостью: это специализированные ополаскиватели, пенки, ершики, нити и огромное разнообразие зубных щеток и паст.
Наконец, даже в обычной жизни пользователь сталкивается с огромным арсеналом средств по уходу за ротовой полостью: это специализированные ополаскиватели, пенки, ершики, нити и огромное разнообразие зубных щеток и паст.
Для того чтобы разобраться, какие темы касательно здоровья и косметологии зубов и десен сейчас наиболее активно изучаются, что изменилось с исторической точки зрения в гигиене ротовой полости и на что в средствах ухода стоит обращать внимание, «Биомолекула» объединила усилия с одним из ведущих производителей и разработчиков в этой области — компанией SPLAT. Результатом сотрудничества стали четыре статьи, которые и представлены в этом спецпроекте.
Каждый из нас, получив какой-то не совсем подходящий, по нашему мнению, подарок, слышал укоризненную фразу «дареному коню в зубы не смотрят». В детстве я заинтересовался ее происхождением и решил расспросить родителей. После непременных «ну, наверное…», «это просто выражение такое.. .» и эпохального «эээ…» мне таки объяснили, что, скорее всего, по внешнему виду лошади сложно определить ее возраст и здоровье, а потому перед покупкой ей заглядывают в рот. Если зубы сточены, значит лошадь старая. Если плохие — в дырках, желтые, отсутствуют, — значит, лошадь плохо кормили, и она скорее всего больна.
.» и эпохального «эээ…» мне таки объяснили, что, скорее всего, по внешнему виду лошади сложно определить ее возраст и здоровье, а потому перед покупкой ей заглядывают в рот. Если зубы сточены, значит лошадь старая. Если плохие — в дырках, желтые, отсутствуют, — значит, лошадь плохо кормили, и она скорее всего больна.
Тогда меня это удовлетворило. Здравый смысл подсказывал, что по такой тривиальной и маленькой части организма, как рот, ничего другого узнать и не выйдет. Но здравый смысл ошибался. Выяснилось, что не только заводчики лошадей, но и ученые — биологи и медики — давно заметили, что различные заболевания отражаются на состоянии полости рта, особенно на деснах. Это оказалось верно не только для лошадей, но и для людей, что, несомненно, куда интереснее.
Что удивительно, плохое состояние полости рта может не только показать, но и предсказать развитие тяжелых, подчас неизлечимых состояний, таких как диабет, ревматоидный артрит или атеросклероз. Как же это происходит? Какие заболевания можно выявить по состоянию зубов и дёсен? Есть ли тут причинно-следственная связь? Что можно предотвратить своевременным лечением и правильной гигиеной? Давайте разберемся.
Иммунный ответ в ротовой полости
Все слизистые оболочки нашего организма заселены комменсальной микробиотой (рис. 1). От нас эти микроорганизмы получают пищу и защиту. Но особенно хорошо живется комменсалу в ротовой полости, поскольку это совершенно особое место. Посудите сами: с наружной средой сообщается, основной поток материи — снаружи внутрь: легко заселиться, не нужно долго путешествовать по ЖКТ, преодолевать агрессивное пространство желудка. Еды вдоволь, поскольку вся пища хозяина тут проходит первичную обработку. Среда умеренно щелочная, почти нейтральная. Единственная проблема — надо совладать с иммунитетом.
Рисунок 1. Сравнение нормальной биопленки на зубах и после чистки зубной щеткой. Пленка для наглядности окрашена фиолетовым красителем.
Иммунный надзор за состоянием ротовой полости — тоже что-то особенное [1]. Эпителий тут тонкий и активно обновляющийся. Слюнные железы создают слабощелочную среду и выделяют антибактериальные ферменты, такие как лизоцим, разрушающий клеточную стенку бактерий. Инфицирование ротовой полости приводит к повреждению эпителиальных клеток и быстрому возникновению воспаления, которое в этой области организма из-за маленькой толщины эпителия ведет к частым кровотечениям и сильному покраснению. Зараженная область атакуется иммунной системой сразу по всем фронтам. Клеточный компонент врожденного иммунитета представлен тучными клетками, нейтрофилами и макрофагами. Гуморальный — лизоцимом, системой комплемента и антителами: эти факторы разрушают мембраны клеток-мишеней или выступают в роли опсонинов .
Инфицирование ротовой полости приводит к повреждению эпителиальных клеток и быстрому возникновению воспаления, которое в этой области организма из-за маленькой толщины эпителия ведет к частым кровотечениям и сильному покраснению. Зараженная область атакуется иммунной системой сразу по всем фронтам. Клеточный компонент врожденного иммунитета представлен тучными клетками, нейтрофилами и макрофагами. Гуморальный — лизоцимом, системой комплемента и антителами: эти факторы разрушают мембраны клеток-мишеней или выступают в роли опсонинов .
Видео. Нейтрофил в мазке крови преследует стафилококка среди эритроцитов. Плазма крови содержит белки системы комплемента (C1—С9), которые собираются на поверхности патогена в белковые «фабрики», производящие растворимые хемоаттрактанты (С3а и С5а) и фиксированные на клеточной стенке опсонины (С3b и C5b). Нейтрофил движется по градиенту хемоаттрактантов и «хватается» своими рецепторами за опсонины для осуществления фагоцитоза. (Заинтересованному читателю может пригодиться подробное описание происходящего на видео.)
Нейтрофил движется по градиенту хемоаттрактантов и «хватается» своими рецепторами за опсонины для осуществления фагоцитоза. (Заинтересованному читателю может пригодиться подробное описание происходящего на видео.)
Подробнее о том, как работает наш иммунитет, рассказано в статье «Иммунитет: борьба с чужими и… своими» [2] из цикла «Аутоиммунные заболевания».
Острое воспаление губительно для большинства бактериальных и грибковых клеток. Потому наша микробиота, живущая на поверхности слизистых, готова на многое, лишь бы его не вызвать. Наши симбиотические бактерии тратят драгоценную энергию и ресурсы на синтез противовоспалительных веществ [3] и отказываются от повреждения таких вкусных на вид клеток эпителия, потому что при их повреждении никакие противовоспалительные стратегии не спасут от активации иммунитета. Кроме того, они создают так называемую колонизационную резистентность — препятствуют заселению освоенного ими эпителия другими микроорганизмами (которые вполне могут вызвать воспаление и навредить комменсалам) [4]. В итоге пользы от них нашему организму больше, чем вреда. Все счастливы.
В итоге пользы от них нашему организму больше, чем вреда. Все счастливы.
Гингивит и пародонтит — власть над хаосом
Хотя острый иммунный ответ способен уничтожить почти любую инфекцию в ее зачатке, некоторым возбудителям удается закрепиться в этих условиях на время, достаточное, чтобы вызвать хроническое воспаление дёсен и связанное с ним заболевание — хронический гингивит. Таких паразитов называют ключевыми патогенами, и найдено их не очень много, все на счету. Самый изученный из них — порфиромонада Porphyromonas gingivalis. В статье мы по большей части будем говорить именно о ней, хотя почти всё сказанное в той или иной мере можно отнести к любому другому ключевому патогену.
Ранее считалось, что такие возбудители тоже страдают от воспаления, но просто научились с ним справляться. Это своеобразные «робинзоны» в суровых условиях воспаленной ткани, старающиеся не быть съеденными и не умереть с голоду. Однако в последнее время появляется всё больше данных, указывающих на то, что эти бактерии на самом деле даже активно способствуют возникновению воспаления . Дело в том, что воспаление деструктивно в отношении не только патогенов, но и собственного организма. А поврежденные ткани для таких паразитов — отличный источник ресурсов.
Дело в том, что воспаление деструктивно в отношении не только патогенов, но и собственного организма. А поврежденные ткани для таких паразитов — отличный источник ресурсов.
Как правило, такие бактерии располагаются на участках дёсен, непосредственно примыкающих к зубу. Они облигатно анаэробны — погибают в присутствии кислорода. По этой причине они формируют защитные биопленки, основой для которых служат устойчивые ткани зуба. Так образуется зубной налет. По мере развития заболевания острое воспаление переходит в хроническое. При этом вокруг зоны воспаления формируется особое дисбиотическое сообщество микроорганизмов, сильно отличающееся от нормального для ротовой полости. В нём можно выделить несколько классов микробионтов.
Первый — собственно инициатор процесса, ключевой патоген. Это бактерии, которые почти всегда обнаруживаются в воспаленной ткани и почти никогда — в здоровой полости рта. К ним относят упомянутую выше P. gingivalis, а также Treponema denticola, Tannerella forsythia и некоторые другие виды. В эксперименте с животными моделями заметили интересную деталь: принудительное заражение P. gingivalis не вызывало гингивита у гнотобиотических животных в отличие от обычных. Из этого ученые сделали вывод, что для успешной колонизации полости рта ключевому патогену нужна помощь нормальной микробиоты [5].
В эксперименте с животными моделями заметили интересную деталь: принудительное заражение P. gingivalis не вызывало гингивита у гнотобиотических животных в отличие от обычных. Из этого ученые сделали вывод, что для успешной колонизации полости рта ключевому патогену нужна помощь нормальной микробиоты [5].
Второй класс включает как раз таких комменсалов-«помощников». Например, Streptococcus gordonii и Aggregatibacter actinomycetemcomitans [6]. S. gordonii вступает в контакт с P. gingivalis через поверхностные белки, и бактерии начинают взаимно стимулировать рост друг друга. Без помощи S. gordonii порфиромонада испытывает большие трудности с формированием устойчивой биопленки. A. actinomycetemcomitans, в свою очередь, обеспечивает колонии защиту от активных форм кислорода — как атмосферного, так и выделяемого нейтрофилами в попытках уничтожить источник воспаления. Это делает ответ врожденного иммунитета непродуктивным, а сообщество — способным выживать в губительных условиях.
Особняком стоят другие «помощники» — реактивированные вирусы из семейства Herpesviridae. Практически 100% человеческой популяции заражены каким-либо представителем этого семейства [7], и показано их участие в развитии многих заболеваний [8]. Однако в норме заражение носит латентный характер: вирус никак себя не проявляет. У пациентов с гингивитом в зоне воспаления часто обнаруживают активировавшийся вирус, а в крови — повышенный титр антител к нему [9]. Причем такая реактивация указывает на более тяжелое течение заболевания. Показано даже, что герпесвирусы способны индуцировать переход гингивита в пародонтит, то есть усугублять патологию. Однако пока не ясно, способны ли они выступать в роли ключевого патогена.
Третий класс микробионтов — страдающий и угнетенный. Это те представители микрофлоры, которые не способны выживать в условиях воспаления. По сути, это почти вся нормальная флора. Особенно крепко ей достается, когда гингивит начинают лечить. Стандартная терапия сейчас предполагает использование антисептиков вроде хлоргексидина, от которых патологические сообщества защищены лучше, чем нормальные. Это ведет к ослаблению их противовоспалительного действия и к нарушению колонизационной резистентности.
Стандартная терапия сейчас предполагает использование антисептиков вроде хлоргексидина, от которых патологические сообщества защищены лучше, чем нормальные. Это ведет к ослаблению их противовоспалительного действия и к нарушению колонизационной резистентности.
Ситуация, в которой иммунный ответ не способен справиться с паразитарной нагрузкой, ведет к переходу острого воспаления в хроническое. При этом начинает меняться сама композиция ткани: активируются фибробласты, макрофаги, моноциты. Если задача острого воспаления — уничтожить захватчиков, то хроническое воспаление стремится их локализовать путем ремоделирования ткани и окружения пораженной области соединительнотканной капсулой.
Ремоделирование ткани, сопровождающее хроническое воспаление, приводит к тому, что близлежащие связки и кости начинают растворяться. Гингивит превращается в пародонтит — состояние, при котором возникает неиллюзорный риск потери зубов. Десна при этом начинает отходить от зуба и постепенно, по мере растворения альвеолярной кости и связок «съезжать» вниз (рис. 2) [10].
2) [10].
Рисунок 2. Сравнение анатомии и микробиологического статуса полости рта в норме, при гингивите и пародонтите.
Ранее медики выделяли пародонтоз как отдельное заболевание. Под этим термином подразумевалась деградация альвеолярных костей и потеря зубов без сопутствующего воспаления. Однако в последнее время такой диагноз уже не ставят, потому что пародонтоз невозможно достоверно отличить от пародонтита.
Разделяй и властвуй — контроль иммунитета при пародонтите
P. gingivalis и организмы-помощники (бактерии и вирусы) совместно создают условия, при которых сообщество способно существовать при постоянном воспалении и под ударами иммунитета. Механизмы этого процесса пока изучены не до конца, поскольку они многочисленны и разнообразны.
Нейтрофилы
Первой линией защиты от гингивита служат нейтрофилы [11]. Во многом благодаря им ключевые патогены, которые постоянно попадают в нашу ротовую полость, уничтожаются задолго до того, как вызывают первые симптомы воспаления. Нейтрофилы — клетки врожденного иммунитета, обладающие двоякой функцией. С одной стороны, они способны к фагоцитозу (поеданию чужеродных организмов), хоть и не такому массированному и эффективному, как макрофаги. С другой же — могут выбрасывать во внешнюю среду активные формы кислорода (АФК), целые сети из собственной ДНК, ферменты и другие белки, токсичные для патогенов.
Нейтрофилы — клетки врожденного иммунитета, обладающие двоякой функцией. С одной стороны, они способны к фагоцитозу (поеданию чужеродных организмов), хоть и не такому массированному и эффективному, как макрофаги. С другой же — могут выбрасывать во внешнюю среду активные формы кислорода (АФК), целые сети из собственной ДНК, ферменты и другие белки, токсичные для патогенов.
Нейтрофилы — это клетки-камикадзе (рис. 3). Они очень эффективны в убийстве больших масс бактерий, но при этом погибают сами. Другие фагоциты съедают остатки и от них самих, и от сраженных ими бактерий. При нормальном ответе на заражение дёсен до 90% всех представленных в зоне поражения активных клеток — нейтрофилы.
Рисунок 3. Нейтрофил осуществляет нетоз — клеточную смерть с выбросом «сетей из ДНК».
Нейтрофильный ответ при пародонтите нарушается на нескольких уровнях. Во-первых, P. gingivalis нарушают синтез хемотаксического фактора IL-8 и молекулы адгезии Е-селектина в клетках эпителия дёсен. Без этих молекул проплывающие мимо зоны поражения нейтрофилы не смогут покинуть капилляр и выйти в ткань. Этот эффект продолжается недолго, но, как правило, его достаточно, чтобы патоген успел закрепиться и включить другие механизмы защиты. Во-вторых, как упоминалось ранее, «помощники» ключевого патогена из числа нормальной микрофлоры способны защищать дисбиотическое сообщество. Например, самое эффективное оружие против нейтрофилов — это выделение ферментов, расщепляющих АФК.
Без этих молекул проплывающие мимо зоны поражения нейтрофилы не смогут покинуть капилляр и выйти в ткань. Этот эффект продолжается недолго, но, как правило, его достаточно, чтобы патоген успел закрепиться и включить другие механизмы защиты. Во-вторых, как упоминалось ранее, «помощники» ключевого патогена из числа нормальной микрофлоры способны защищать дисбиотическое сообщество. Например, самое эффективное оружие против нейтрофилов — это выделение ферментов, расщепляющих АФК.
Интересно то, что нейтрофилы нужны патогенам! Вероятно, именно поэтому блокировка хемотаксиса имеет небольшую продолжительность во времени. Дело в том, что инфламмофильной флоре нужно воспаление тканей, чтобы нормально питаться, а никто не вызывает его лучше активированных нейтрофилов. Потому после выставления защиты новообразованной биопленки от повреждающих факторов контроль нейтрофилов практически прекращается. В результате, нейтрофилы оказываются одним из основных факторов, повреждающих десну и альвеолярную кость при пародонтите.
Комплемент
Система комплемента — древняя часть врожденного гуморального иммунитета. Комплемент представляет собой комплекс последовательно активирующихся белков плазмы (рис. 4). При активации они покрывают поверхность патогена, стимулируют хемотаксис фагоцитов и облегчают фагоцитоз. Некоторые патогены даже могут быть уничтожены только белками комплемента без привлечения других ветвей иммунитета.
Рисунок 4. Различия в пути активации системы комплемента в норме и при гингивите и его воздействие на нейтрофилы. Синие стрелки — обычные для организма реакции. Красные стрелки — бактериальные ферменты.
Показано, что P. gingivalis способна расщеплять один из белков комплемента С5 на С5а и С5b без активации вышележащих путей (рис. 4). В результате в области воспаления оказывается большое количество С5а. Это привлекает в нее дополнительные нейтрофилы, но очень интересным образом на них действует. Дело в том, что ключевые патогены активируют на поверхности нейтрофилов рецепторы TLR2, которые узнают пептидогликан клеточной стенки. В сочетании с рецептором С5а это приводит к подавлению фагоцитоза и усилению провоспалительной и дегранулирующей активности [12]. В итоге вместо уничтожения бактерий, нейтрофилы разрушают ткани. Инфламмофилы торжествуют!
В сочетании с рецептором С5а это приводит к подавлению фагоцитоза и усилению провоспалительной и дегранулирующей активности [12]. В итоге вместо уничтожения бактерий, нейтрофилы разрушают ткани. Инфламмофилы торжествуют!
В свою очередь другой компонент системы комплемента (С3) уничтожается бактериями. Таким образом, комплемент переходит под практически полный бактериальный контроль и служит их целям вместо защиты организма.
Белки, контролирующие систему комплемента, обнаружены у всех ключевых патогенов гингивита, что указывает на важность нарушения этого слоя иммунной системы для успеха заражения [13].
Иные способы контроля иммунитета
Вышеприведенные пути контроля воспаления и иммунного ответа являются самыми изученными, но не единственными. Сегодня изучают различные межбактериальные связи в дисбиотическом сообществе, при которых оно защищает свои отдельные виды от видоспецифичной атаки. Также при гингивите нарушается активация хелперных лимфоцитов (с молекулами CD4 на поверхности) и преимущественная дифференцировка их в сторону провоспалительного 2-го типа, а не направленного против внутриклеточных бактерий 1-го. Это, в частности, приводит к незавершенному фагоцитозу бактерий во время процессов, описанных далее. Исследование механизмов контроля иммунитета продолжается.
Это, в частности, приводит к незавершенному фагоцитозу бактерий во время процессов, описанных далее. Исследование механизмов контроля иммунитета продолжается.
Путь к сердцу лежит…
Как говорилось в предисловии, пародонтит и гингивит часто сопровождают, а порой и предсказывают риск развития определенных системных заболеваний. В этот список входят метаболические нарушения, атеросклероз, некоторые формы онкологических заболеваний, аутоиммунные болезни и многое другое. Ученые довольно сильно углубились в исследования механизмов этих процессов и нашли уже много чего интересного. Например, почти все эти процессы так или иначе связаны с ключевым патогеном, а наша микрофлора почти не принимает участия в этой ветви патогенеза гингивита. Частично мы уже разобрались, как именно это происходит. Рассмотрим все по порядку.
Сердечно-сосудистые заболевания
Наиболее сильная ассоциация в этой группе состояний выявлена между гингивитом и атеросклерозом [14]. Ученые обнаружили, что воспалительные заболевания полости рта — независимый фактор развития этого состояния.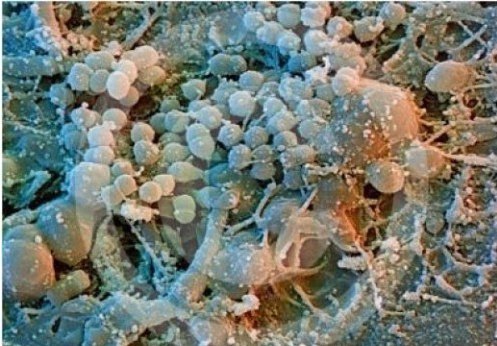 Важным вопросом в таких случаях является наличие причинно-следственных связей: сам ли гингивит — причина повышенного риска, или некий неизвестный пока фактор повышает риск и атеросклероза, и гингивита? Имеющиеся на сегодня данные указывают на первый вариант (то есть при прочих равных у человека с пародонтитом риск заболеть атеросклерозом выше, чем у здорового).
Важным вопросом в таких случаях является наличие причинно-следственных связей: сам ли гингивит — причина повышенного риска, или некий неизвестный пока фактор повышает риск и атеросклероза, и гингивита? Имеющиеся на сегодня данные указывают на первый вариант (то есть при прочих равных у человека с пародонтитом риск заболеть атеросклерозом выше, чем у здорового).
Ученые обнаружили несколько механизмов, посредством которых гингивит может влиять на состояние сосудов. Холестериновая бляшка — это не просто однородное нагромождение. Она имеет сложную структуру, частью которой являются так называемые «пенистые» клетки — макрофаги, наевшиеся холестериновых фрагментов и выглядящие под микроскопом как будто наполненные пеной (рис. 5). Важный фактор атеросклероза — воспаление интимы (внутреннего слоя стенки) сосуда, привлекающее макрофаги.
Рисунок 5. Атеросклеротическая бляшка в сосуде. В нижней части бляшки — пенистые клетки.
Показано, что у людей с гингивитом и атеросклерозом в бляшках можно обнаружить ключевых патогенов заболеваний полости рта.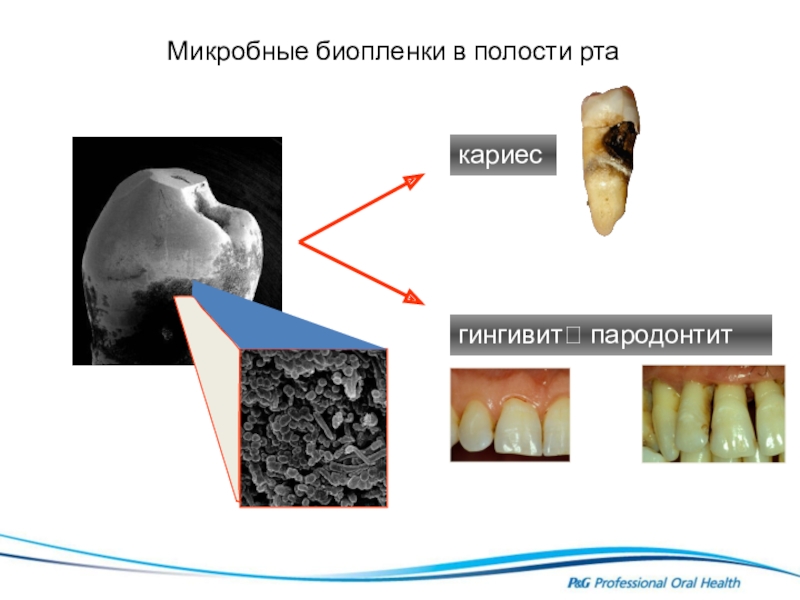 Как мы помним, они являются анаэробами и инфламмофилами, так что атеросклеротическая бляшка для них — более чем приемлемое место обитания. Более того, они вполне способны создать ее самостоятельно, вызвав воспаление в месте своего прикрепления после проникновения в кровь. Но как же они туда попадают? На это есть два возможных ответа.
Как мы помним, они являются анаэробами и инфламмофилами, так что атеросклеротическая бляшка для них — более чем приемлемое место обитания. Более того, они вполне способны создать ее самостоятельно, вызвав воспаление в месте своего прикрепления после проникновения в кровь. Но как же они туда попадают? На это есть два возможных ответа.
Во-первых, если переусердствовать с чисткой зубов при гингивите и вызвать кровотечение, часть дисбиотической флоры попадает в кровь и вызывает слабую бактериемию [15]. Однако этот путь проникновения, предположительно, не может быть основной причиной повышенного риска атеросклероза при гингивите — бактерии не готовы выживать в токсичной для них крови. Куда более перспективным с точки зрения патогенов является их путешествие по организму внутри фагоцитов после незавершенного фагоцитоза [16].
Помимо бактериемии предложено еще несколько механизмов. Обнаружено, что выделение провоспалительных цитокинов в зоне пародонтита может спровоцировать системный воспалительный ответ в печени, тем самым создав предпосылки к развитию воспаления сосудов [17]. Также отмечено, что по неизвестному пока пути пародонтит сильно меняет состав кишечной микрофлоры, снижая ее противовоспалительные способности и вызывая системное воспаление [18]. Сами ключевые патогены в кишечнике при этом, однако, не обнаруживаются.
Также отмечено, что по неизвестному пока пути пародонтит сильно меняет состав кишечной микрофлоры, снижая ее противовоспалительные способности и вызывая системное воспаление [18]. Сами ключевые патогены в кишечнике при этом, однако, не обнаруживаются.
Помимо атеросклероза, на мышах показано, что воспаление ротовой полости ведет к снижению скорости восстановления миокарда после инфаркта. Имеются данные по связи пародонтита с риском развития коронарной недостаточности сердца [17]. Однако ассоциация пародонтита со всеми другими сердечно-сосудистыми заболеваниями куда более зыбкая, нежели с атеросклерозом.
Осложнения при беременности
Заболевания полости рта также плохо влияют на плод. Отмечено снижение массы новорожденного, повышение риска преждевременных родов, выкидыша и мертворождения. Ученые рассматривают два возможных механизма. В первом случае некоторые бактерии, вызывающие пародонтит, проникают через плаценту. Что интересно, в отличие от атеросклероза это не ключевые патогены, а бактерии-помощники — часть нормальной флоры ротовой полости, измененная под влиянием P. gingivalis или других индукторов. Второй механизм указывает на провоспалительный фон, который создает в организме матери пародонтит. При воспалении ресурсы организма распределяются по принципу «сначала мать, потом дитя» [10].
gingivalis или других индукторов. Второй механизм указывает на провоспалительный фон, который создает в организме матери пародонтит. При воспалении ресурсы организма распределяются по принципу «сначала мать, потом дитя» [10].
Аутоиммунные заболевания
Среди состояний, при которых иммунитет обращается против своего владельца, наиболее сильна и изучена связь пародонтита с ревматоидным артритом (рис. 6) [19]. Интересно, что если во всех предыдущих случаях излечение пародонтита ведет к улучшению состояния пациента (снижается количество новых бляшек, снижается вероятность выкидыша и т.д.), то в случае с артритом заболевание полости рта только повышает риск его возникновения. Излечение же дёсен никак не помогает заболевшим: далее артрит развивается независимо от наличия или отсутствия пародонтита.
Рисунок 6. Суставы рук в норме (слева) и при ревматоидном артрите.
Механизм, по которому повышается риск заболевания, довольно своеобразен.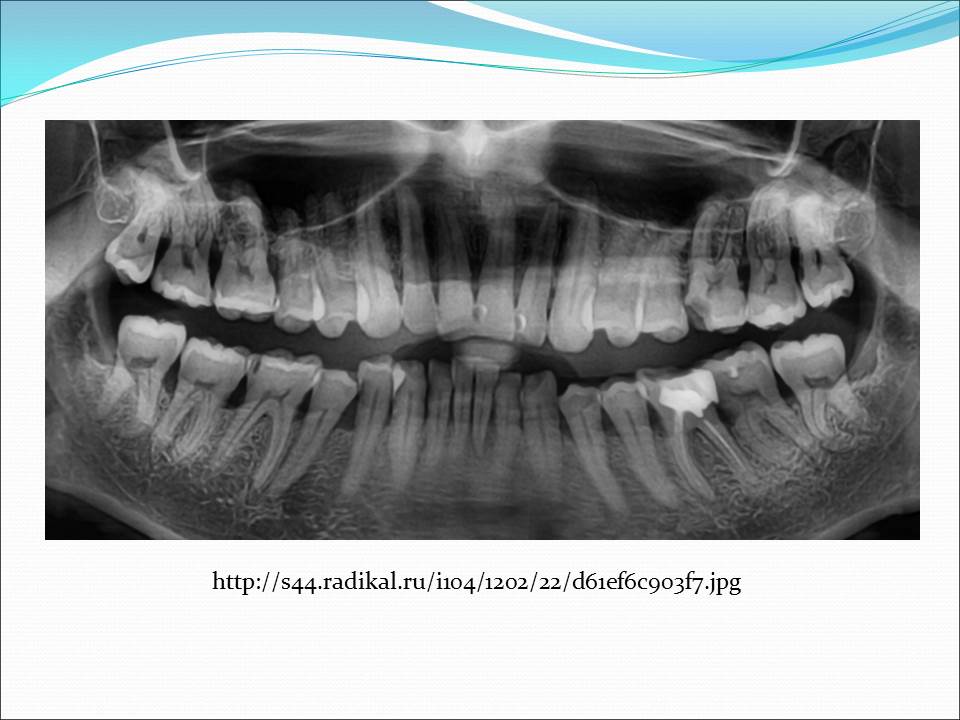 У самого частого патогена, вызывающего гингивит и пародонтит, P. gingivalis, есть фермент пептидил-аргинин-деиминаза, который бактерия выделяет во внешнюю среду. Его функция заключается в том, что он отыскивает в белках аминокислоту аргинин и превращает ее в цитруллин, не меняя сам белок. Такие цитруллинированные белки собственного организма способны вызвать иммунный ответ, прежде всего антительный. Интересно, что более чем в половине случаев ревматоидного артрита у пациентов обнаруживают антитела к цитруллинированным белкам. В первую очередь при пародонтите этому воздействию подвергаются факторы роста соединительной ткани.
У самого частого патогена, вызывающего гингивит и пародонтит, P. gingivalis, есть фермент пептидил-аргинин-деиминаза, который бактерия выделяет во внешнюю среду. Его функция заключается в том, что он отыскивает в белках аминокислоту аргинин и превращает ее в цитруллин, не меняя сам белок. Такие цитруллинированные белки собственного организма способны вызвать иммунный ответ, прежде всего антительный. Интересно, что более чем в половине случаев ревматоидного артрита у пациентов обнаруживают антитела к цитруллинированным белкам. В первую очередь при пародонтите этому воздействию подвергаются факторы роста соединительной ткани.
Ответ на цитруллинированные белки лишь прокладывает путь к заболеванию. Далее начинается процесс, который в англоязычной литературе называется antigen spreading, дословно — антигенное расползание. Дело в том, что антигеном, то есть узнаваемой молекулой для адаптивного иммунитета, являются небольшие кусочки белков. Если сначала иммунный ответ возникает только к цитруллинированным фрагментам, то постепенно «расползается» на неизмененные пептиды, а оттуда — на другие белки, не встречающиеся в цитруллинированном виде. Общее провоспалительное состояние организма завершает дело — возникает аутоиммунное заболевание.
Диабет второго типа
Много исследований посвящено поиску связи между пародонтитом и диабетом второго типа, или «диабетом пожилых», как называют его патологи. Его стоит отличать от диабета первого типа, имеющего аутоиммунную природу [20]. В отличие от предыдущих заболеваний, однако, в этом случае ученые сконцентрировались скорее на изучении пародонтита, возникающего у больных диабетом, нежели на возникновении диабета у людей с воспалением дёсен. Впереди планеты всей в этих исследованиях страховые компании. Это неудивительно в свете старения популяции — они ищут способы повысить эффективность лечения и/или снизить его цену [21].
Отмечено, что пациенты-диабетики без пародонтита лучше поддаются лечению и, что немаловажно для страховщиков, дешевле обходятся, чем страдающие заболеваниями полости рта. Пародонтит у таких больных встречается чаще, чем в целом по популяции, а значит, его экономически эффективно выявлять и лечить.
Онкологические заболевания
Отдельные ключевые патогены оказались «замешаны» и в развитии некоторых онкологических заболеваний. Тут связь оказалась видоспецифична, что указывает на то, что именно патоген, а не вызываемый им пародонтит, является причиной повышения риска заболевания.
Подробно разобранная в статье Porphyromonas gingivalis оказалась связана с вероятностью заболеть плоскоклеточной орофарингеальной карциномой. Причиной этому является воздействие патогена на различные сигнальные пути в эпителиальных клетках ротоглотки, что приводит к блокаде апоптоза и стимуляции деления. Также P. gingivalis способствует выработке этими клетками протеазы MMP9, с помощью которой они могут разжижать матрикс и покидать место своего образования, создавая метастазы [22]. Отмечена связь этого микроба с развитием рака поджелудочной железы, но тут механизмы пока не разобраны.
Другой ключевой патоген, Fusobacterium nucleatum, в отличие от P. gingivalis, способен проходить желудок и достигать кишечника. Там он взаимодействует с эпителиальными клетками толстого кишечника и способствует их выживанию и делению. Таким образом он способен стимулировать развитие рака толстой кишки, что подтверждается и лабораторными исследованиями — раковые клетки лучше растут, если в среде присутствует Fusobacterium nucleatum [23].
Таким образом, даже если у человека не развивается гингивит в присутствии ключевых патогенов, они все равно могут быть опасны.
Другие заболевания
Вышеперечисленные состояния представляют собой отнюдь не исчерпывающий список того, что исследуется в связи с пародонтитом. Другие заболевания или менее значимы, или хуже изучены, причем вторая опция пока что встречается чаще. Ученые отмечают связь болезней полости рта с бронхиальной астмой и аспирационной пневмонией, хронической почечной недостаточностью и обструктивной болезнью легких. В ближайшие годы стоит ждать новых открытий в этих областях. Но даже с имеющимися данными ясно, что следить за полостью рта — важная со всех сторон задача. Так как же не заболеть гингивитом или вылечиться, если вы уже заболели? Об этом — в следующей главе.
Клиника пародонтита: как не заболеть и чем лечить
Факторы риска
Основной причиной возникновения пародонтита и гингивита является возникновение дисбиотического бактериального (иногда бактериально-герпесвирусного) сообщества, управляемого «ключевым патогеном», — как правило, Porphyromonas gingivalis или подобным ему анаэробом. Но для формирования сообщества нужно, чтобы потенциальный хозяин ключевого патогена был к этому готов [9].
Первый фактор риска — это генетическая предрасположенность. Гены-кандидаты пока достоверно не установлены, и предположение о генетическом вкладе делается на основе разной уязвимости к пародонтиту у людей с одинаковым набором факторов окружающей среды. Исследования по этой теме сейчас ведутся.
Следующим по значимости фактором можно считать «переходный» гормональный фон. Наиболее подвержены гингивиту юноши и девушки в период полового созревания, беременные женщины, женщины в менопаузе, диабетики, — то есть люди, чей гормональный фон нарушен или меняется. Как правило, такое состояние связано с ослаблением иммунитета в целом, что открывает окно для входа патогенов.
Заболевания, снижающие иммунную защиту, такие как СПИД или рак, а также прием иммуносупрессоров тоже могут являться причиной довольно серьезного пародонтита. Такие нарушения структуры полости рта, как хирургическое вмешательство, установка имплантов и т.д. также вносят свой вклад в развитие заболевания.
Недостаточная гигиена полости рта и курение завершают этот список.
Как защитить зубы и дёсны? Отвечает компания SPLAT
Среди зубных паст SPLAT присутствуют продукты, основное действие которых направлено на дёсны — на поддержание их в здоровом состоянии и профилактику гингивита. Это, например, зубные пасты «Лавандасепт», «Зеленый чай» и «Актив» в серии Professional и Siberry, Love и Chili в серии Special. Они содержат экстракты и эфирные масла растений, которые за счет своих противовоспалительных и антибактериальных свойств способствуют улучшению состояния тканей пародонта.
Так, зубная паста Love содержит дикалий глицирризинат — соль глирризиновой кислоты, основного компонента экстракта корня лакричника, — и экстракт семян периллы. Эти компоненты подавляют рост микроорганизмов и тем самым способствуют профилактике кариеса [24], [25]. Кроме того, сама глицирризиновая кислота — продукт гидролиза глицирризината калия — обладает противовирусным действием. Она ингибирует фосфокиназу и останавливает фосфорилирование клеточных и кодируемых вирусом белков в инфицированных клетках. А также инактивирует вирусы вне клеток, при этом вирус простого герпеса — необратимо [26].
Зубная паста Chili содержит экстракт острого чили-перца, который улучшает кровообращение и трофику тканей дёсен, увеличивая их упругость и плотность. Содержащийся в нем капсаицин — жгучее вещество перца чили [27] — обладает сильным иммуностимулирующим действием и препятствует развитию инфекционных заболеваний ротовой полости [28].
Зубная паста Siberry («Сибирские ягоды») в дополнение к экстрактам ягод брусники, можжевельника, облепихи, клюквы и земляники содержит соединения цинка с ярко выраженными антибактериальными свойствами. Также в ее состав включен натуральный комплекс ферментов лактоферрина и лактопероксидазы. Он поддерживает местный иммунитет полости рта и подавляет рост вредных бактерий [29–31].
Настоящей инновацией является система Sp.White New, которая включает в себя бромелаин и лизаты бактерий, способствующие сохранению нормального состояния иммунитета слизистой оболочки полости рта и поддержанию баланса микробиоты. Эта система находится в продуктах Sensitive White и Sensitive Ultra.
Поскольку в подавляющем большинстве случаев причины гингивита — бактериальные, пасты с хорошими очищающими характеристиками также могут быть рекомендованы к применению. Это продукты серии Special и Professional.
Кроме того, важно пользоваться дополнительными средствами гигиены полости рта — ополаскивателями, пенками и зубными нитями.
Материал предоставлен партнёром — компанией SPLAT
Лечение пародонтита
Различные варианты монотерапии гингивита и пародонтита, применяющиеся последние 100 лет, оказались недостаточно эффективными. По отдельности ни хирургия, ни антибиотики, ни антисептические полоскания рта не могут справиться с образованной патогенами биопленкой.
В XX веке классическим лечением тяжелых форм пародонтита являлись различные хирургические вмешательства вроде раскрытия десневых карманов или удаления воспаленной части десны. Однако в конце века установили, что они неэффективны: воспаление сохраняется, а развитие пародонтита даже не замедляется [32].
Сейчас в клинике лечение пародонтита ведется комплексно, в две стадии. На первом этапе необходимо разрушить биопленку механически в кресле стоматолога. На втором применяют антимикробную терапию с использованием антисептиков, таких как хлоргексидин или раствор гипохлорита натрия. По отдельности эти методы работают плохо, но в комплексе дают сильный терапевтический эффект. При агрессивном течении заболевания могут также применять антибиотики широкого спектра — тетрациклины [33].
Также хорошие результаты показывает соблюдение гигиенических правил. Например, эффективна обычная регулярная чистка зубов. Ученые расходятся в оценках минимально необходимой частоты и делятся на два лагеря — «адепты 24-часового цикла» (один раз в день) и «адепты 12-часового цикла» (дважды в день).
Хорошо зарекомендовало себя и не очень частое использование некоторых антисептиков. Например, орошение полости рта 0,25-процентным раствором гипохлорита натрия не только эффективно предотвратило развитие пародонтита, но и улучшило многие другие косвенные параметры здоровья полости рта — например, кардинально снизило кровоточивость при зондировании десневых карманов. Другие антисептики, такие как хлоргексидин, не оказались успешны. Триклозан же, часто применяемый в зубных пастах, помимо отсутствия значимого эффекта, еще имеет и потенциальные побочные эффекты. Из-за этого с 2017 года его включение в антибактериальные средства для мытья рук и тела запрещено FDA [34].
Резюмируя, можно сказать, что исследования в области связи заболеваний полости рта с различными системными патологиями уже принесли массу неожиданных результатов. И отнюдь не зря в старину покупатель рассматривал зубы у лошади — наметанный глаз много чего мог сказать о будущей покупке.
В следующей статье нашего цикла мы перейдем к другому состоянию полости рта. Хоть оно и грозит меньшими проблемами со здоровьем, нежели пародонтит, но куда сильнее бьет по нашей социальной жизни. Речь пойдет о плохом запахе изо рта — галитозе.
- Małgorzata Nędzi-Góra, Jan Kowalski, Renata Górska. (2017). The Immune Response in Periodontal Tissues. Arch. Immunol. Ther. Exp.. 65, 421-429;
- Иммунитет: борьба с чужими и… своими;
- Graham A. W. Rook. (2012). Hygiene Hypothesis and Autoimmune Diseases. Clinic Rev Allerg Immunol. 42, 5-15;
- Andreas Schwiertz Microbiota of the Human Body — Springer International Publishing, 2016;
- Qian Yin, Su-Chang Lin, Betty Lamothe, Miao Lu, Yu-Chih Lo, et. al.. (2009). E2 interaction and dimerization in the crystal structure of TRAF6. Nat Struct Mol Biol. 16, 658-666;
- G. Hajishengallis, R.J. Lamont. (2012). Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Microbiol Oral Immunol. 27, 409-419;
- Bjørn Grinde. (2013). Herpesviruses: latency and reactivation – viral strategies and host response. Journal of Oral Microbiology. 5, 22766;
- От поцелуя до лимфомы один вирус;
- Jørgen Slots. (2017). Periodontitis: facts, fallacies and the future. Periodontol 2000. 75, 7-23;
- George Hajishengallis. (2014). Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 15, 30-44;
- E. Hajishengallis, G. Hajishengallis. (2014). Neutrophil Homeostasis and Periodontal Health in Children and Adults. J Dent Res. 93, 231-237;
- Tomoki Maekawa, Jennifer L. Krauss, Toshiharu Abe, Ravi Jotwani, Martha Triantafilou, et. al.. (2014). Porphyromonas gingivalis Manipulates Complement and TLR Signaling to Uncouple Bacterial Clearance from Inflammation and Promote Dysbiosis. Cell Host & Microbe. 15, 768-778;
- K. Popadiak, J. Potempa, K. Riesbeck, A. M. Blom. (2007). Biphasic Effect of Gingipains from Porphyromonas gingivalis on the Human Complement System. The Journal of Immunology. 178, 7242-7250;
- Amol Ashok Bahekar, Sarabjeet Singh, Sandeep Saha, Janos Molnar, Rohit Arora. (2007). The prevalence and incidence of coronary heart disease is significantly increased in periodontitis: A meta-analysis. American Heart Journal. 154, 830-837;
- P. B. Lockhart, M. T. Brennan, H. C. Sasser, P. C. Fox, B. J. Paster, F. K. Bahrani-Mougeot. (2008). Bacteremia Associated With Toothbrushing and Dental Extraction. Circulation. 117, 3118-3125;
- Michael T Certo, Kamila S Gwiazda, Ryan Kuhar, Blythe Sather, Gabrielle Curinga, et. al.. (2012). Coupling endonucleases with DNA end–processing enzymes to drive gene disruption. Nat Meth. 9, 973-975;
- Robert J. Genco, Thomas E. Van Dyke. (2010). Reducing the risk of CVD in patients with periodontitis. Nat Rev Cardiol. 7, 479-480;
- Kei Arimatsu, Hitomi Yamada, Haruna Miyazawa, Takayoshi Minagawa, Mayuka Nakajima, et. al.. (2015). Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota. Sci Rep. 4;
- Ревматоидный артрит: изменить состав суставов;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Marjorie K. Jeffcoat, Robert L. Jeffcoat, Patricia A. Gladowski, James B. Bramson, Jerome J. Blum. (2014). Impact of Periodontal Therapy on General Health. American Journal of Preventive Medicine. 47, 166-174;
- Joseph Katz, Mairelys D Onate, Kaleb M Pauley, Indraneel Bhattacharyya, Seunghee Cha. (2011). Presence of Porphyromonas gingivalis in gingival squamous cell carcinoma. Int J Oral Sci. 3, 209-215;
- Mara Roxana Rubinstein, Xiaowei Wang, Wendy Liu, Yujun Hao, Guifang Cai, Yiping W. Han. (2013). Fusobacterium nucleatum Promotes Colorectal Carcinogenesis by Modulating E-Cadherin/β-Catenin Signaling via its FadA Adhesin. Cell Host & Microbe. 14, 195-206;
- Liu G., He Y.H., Zhang F.F., Kong X.L., Wen Y.L., Ma Q.R. et al. (2010). Effects of glycyrrhizic acid on the growth and acid-producing of Streptococcus mutans in vitro. Sichuan Da Xue Xue Bao Yi Xue Ban. 41, 634–637;
- Azuma K., Ito H., Ippoushi K., Higashio H. (2003). In vitro antibacterial activity of extracts from four Labiatae herbs against Helicobacter pylori and Streptococcus mutans. Yasai Chagyou Kenkyuujo kenkyuu houkoku. 2, 83–91;
- Pompei R., Pani A., Flore O., Marcialis M.A., Loddo B. (1980). Antiviral activity of glycyrrhizic acid. Experientia. 36, 304;
- Жгучий перец облегчит боль;
- Presser A. (2009). Cayenne (Capsicum annuum; C. frutescens). Huntington College of Health Sciences;
- Atmaca S. (1998). The effect of zinc on microbial growth. Tr. J. of Medical Sciences. 28, 595–597;
- Xanthou M. (1998). Immune protection of human milk. Biol. Neonate. 74, 121–133;
- Hoogedoorn H. Activation of the salivary peroxidase system: clinical studies. In: The Lactoperoxidase system: chemistry and biological significance / ed. by Tenovuo J.O. and Pruitt K.M. NY: Dekker, 1985. P. 217–228;
- S. P. Ramfjord, R. G. Caffesse, E. C. Morrison, R. W. Hill, G. J. Kerry, et. al.. (1987). 4 modalities of periodontal treatment compared over 5 years*. J Clin Periodontol. 14, 445-452;
- Ranjitha Krishna, Jamie A. De Stefano. (2016). Ultrasonic vs. hand instrumentation in periodontal therapy: clinical outcomes. Periodontol 2000. 71, 113-127;
- FDA issues final rule on safety and effectiveness of antibacterial soaps. (2016). Сайт FDA;
- Tomas Lang, Sebastian Staufer, Barbara Jennes, Peter Gaengler. (2014). Clinical validation of robot simulation of toothbrushing — comparative plaque removal efficacy. BMC Oral Health. 14.
Бактерии, вызывающие пародонтит, могут способствовать развитию ревматоидного артрита (1554) — Стоматология — Новости и статьи по стоматологии
Исследователи из университета Джона Хопкинса получили новые доводы, свидетельствующие о том, что бактерии, вызывающие хронические воспалительные заболевания десен также запускают иммунные реакции, связанные с хроническим ревматоидным артритом. Ученые надеются, что новые данные позволят внести существенные коррективы в терапию ревматоидного артрита (РА) и даже его профилактику.
В докладе утверждается, что у пациентов с РА и пациентов с болезнями пародонта часто встречается одна и та же бактерия — Aggregatibacter actinomycetemcomitans. По-видимому, воспаления, вызываемые бактерией A. actinomycetemcomitans, увеличивают выработку цитруллинированных белков, которые, как предполагается, активируют иммунную систему и запускают каскад реакций, приводящих к ревматоидному артриту.
«Мы как будто наконец нашли две недостающие детали этого медицинского паззла, над которым работали долгие годы», — говорит д.м.н. Филипе Андраде, автор работы, преподаватель в Медицинской школе университета Джона Хопкинса и практикующий врач в Медицинском центре Бэйвью университета Дж. Хопкинса.
«Вероятно, это одно из наиболее значимых открытий, которое позволит нам понять причину развития ревматоидного артрита», — говорит один из авторов работы, д.м.н. Максимилиан Кениг, врач Главной Массачусетской больницы.
Ученые заметили взаимосвязь болезней пародонта и РА в медицинских картах с начала прошлого века и пришли к выводу о том, что оба заболевания могут быть вызваны одним возбудителем. В более ранних исследованиях другие ученые склонялись к тому, что этим патогеном может быть бактерия Porphyromonas gingivalis, вызывающая пародонтит. Однако не удавалось доказать, что эта бактерия также вызывает РА, запуская выработку цитруллинированных белков. Эти исследования зашли в тупик, тем не менее, ученые продолжали искать другие варианты патогенов, которые могут связывать два этих заболевания.
Авторы данной работы – группа исследователей-экспертов в области микробиологии полости рта, болезней пародонта и ревматоидного артрита. Они также попытались найти общую причину для двух заболеваний. Изначально, проанализировав образцы тканей пародонта и образцы тканей суставов пациентов с РА, удалось определить, что в них происходит одинаковый процесс – повышенная выработка цитруллинированных белков.
Д-р Андраде поясняет, что цитруллинирование – естественный биологический процесс, с помощью которого осуществляется регуляция функций белков. Тем не менее, у больных ревматоидным артритом происходит ускорение этого процесса, в результате это приводит к повышенной выработке цитруллинированных белков. В ответ на это организм начинает производить антитела к данному типу белков, далее возникает воспалительный процесс и организм атакует собственные ткани. Эти процессы являются отличительными клиническими симптомами ревматоидного артрита.
Среди различных патогенов, вызывающих пародонтит, только бактерия A. actinomycetemcomitans запускает гиперцитруллинирование в нейтрофилах – типе лейкоцитов с высоким уровнем фермента пептидиларгинин дезаминазы (ПАД), необходимого для процесса цитруллинирования. Нейтрофилы – наиболее распространенная группа воспалительных клеток в тканях суставов и тканях пародонта пациентов с РА и пародонтозом, как утверждают исследователи. В течение многих лет эти клетки находятся в центре исследований, рассматриваемые в качестве основной причины гиперцитруллинирования у больных РА.
Бактерия A. actinomycetemcomitans запускает процесс повышенной выработки цитруллинированных белков путем секреции лейкотоксина А – это защитная реакция патогена, позволяющая ему уничтожать иммунные клетки хозяина. Лейкотоксин А создает отверстия на поверхности нейтрофилов, через которей поток ионов кальция проникает внутрь клетки. Внезапное изменения концентрации кальция активирует выработку ферментов ПАД, запуская процесс гиперцитруллинирования белков.
Ранее ученые обнаружили, что подобный тип белков, формирующих отверстия на поверхности клеток, производимых иммунными клетками организма для борьбы с патогеном, запускает процесс гиперцитруллинирования белков в суставах больных РА. Результаты свидетельствуют о схожести двух процессов, основанных на создании отверстий в клетках, при этом, вероятно, что именно такой механизм действует в самом начале развития ревматоидного артрита.
В рамках работы, используя штамм бактерий A. Actinomycetemcomitans и лейкотоксин А, исследователи разработали тест, определяющий в крови наличие антител к бактерии A. actinomycetemcomitans. Взяв образцы крови у 196 пациентов с РА, ученые обнаружили, что почти у половины участников (92 из 196) есть признаки воспаления, вызванного патогеном A. actinomycetemcomitans. Изучив результаты тестирования больных пародонтитом, оказалось, что у 60% участников тест на наличие антител к патогену положительный. Среди участников контрольной группы данный показатель составил всего 11%. Более того, введя в образцы крови участников эксперимента с генетической предрасположенностью к РА патоген A. actinomycetemcomitans, обнаружили, что именно этот фактор запускает продукцию антител к цитруллинированным белкам.
Тем не менее, автор работы д-р Андраде подчеркнул, что у более чем 50% участников исследования с РА не было выявлено воспалительных процессов, связанных с бактерией A. actinomycetemcomitans. По его словам, это свидетельствует о том, что вероятно существуют другие патогены в кишечнике, легких или других органах, использующие схожий механизм, вызывающий гиперцитруллинирование белков.
Д-р Андраде также подчеркивает, что в исследование приняли участие больные с диагностированным хроническим РА. Чтобы доказать роль бактерий A. actinomycetemcomitans в развитии РА, требуется дальнейшая исследовательская работа с участием больных с РА различной степени тяжести, чтобы проследить развитие болезни от самого начала до хронической стадии. По его словам, такие исследования могут занять десятилетия. «Возможно, если мы изучим эволюцию обеих болезней и в будущем сможем предотвращать их, а не просто снимать симптомы».
Бактерии, вызывающие пародонтит, могут препятствовать зачатию ребенка (1874) — Стоматология — Новости и статьи по стоматологии
Проведя исследование, ученые из университета Хельсинки (Финляндия) пришли к выводу, что возбудители пародонтита могут вызывать проблемы с зачатием ребенка у молодых женщин. Ранее удалось доказать, что болезни пародонта повышают риск системных заболеваний. Однако данные о взаимосвязи пародонтита и более позднего наступления беременности были получены впервые.
«Исходя из результатов, мы рекомендуем женщинам детородного возраста тщательно следить за здоровьем полости рта и регулярно проходить стоматологические осмотры», — говорит врач-стоматолог Сюзанна Пайю из университета Хельсинки.В исследование были включены 256 здоровых небеременных женщин в возрасте от 19 до 42 лет. Средний возраст участниц составил 29,2 года. С целью забеременеть, участницы прекратили прием контрацептивов. В рамках 1 этапа провели клинический осмотр состояния зубов и десен, а также осмотр гинеколога. Далее у участниц взяли пробы слюны и анализ крови – для анализа микрофлоры и определения наличия антител к возбудителям пародонтита. Также провели исследование влагалищных мазков для диагностики бактериального вагиноза.
Участниц наблюдали на протяжении 12 месяцев и регистрировали случаи наступления беременности.
По итогам работы установили, что высокая концентрация бактерий Porphyromonas gingivalis – возбудителей пародонтита — отмечалась у женщин, у которых беременность не наступила в течение 12 месяцев, по сравнению с участницами, которые сумели зачать ребенка за этот период. Также в образцах крови и слюны этих участниц обнаружилось большая концентрация антител к этому штамму бактерий.
Исследователи провели статистический анализ данных участниц, чтобы исключить другие факторы риска, способные повлиять на скорость зачатия, как: возраст, курение, социально-экономический статус, бактериальный вагиноз, предыдущая беременности, пародонтит.
У участниц с высокой концентрации бактерий P. gingivalis в образце слюны или антител к этому патогену в сыворотке крови, вероятность зачатия в 3 раза ниже, по сравнению со здоровыми женщинами. В случае, если также присутствуют клинические признаки пародонтита – вероятность проблем с зачатием возрастает в 4 раза.
«В рамках исследования мы не рассматривали причины взаимосвязи бактерий-возбудителей пародонтита и вероятности бесплодия. Тем не менее, мы можем утверждать, что эта патогенная бактерия даже в малых количествах оказывает негативный эффект на организм в целом, еще до появления первых признаков пародонтита. Нам потребуется провести дополнительные исследования, чтобы определить причину обнаруженной взаимосвязи», — говорит д-р Пайю.
Бесплодие – серьезная медицинская проблема, требующая исследовательской работы. Также следует глубже изучить воздействие бактерий, ответственных за развитие пародонтита, на организм в целом. Мы рекомендует молодым женщинам соблюдать правила гигиены полости рта и регулярно посещать стоматологию, при планировании беременности.
Повторное посещение зубного налета: бактерии, вызывающие заболевания пародонта
Между 3-12 неделями после начала образования наддесневого налета устанавливается отличительная поддесневая микрофлора, состоящая преимущественно из грамотрицательных анаэробных бактерий и в том числе некоторых подвижных видов. Для того, чтобы закрепиться в области пародонта, вид должен иметь возможность прикрепляться к одной из нескольких поверхностей, включая зуб (или вещества, происходящие от хозяина, прилипающие к зубу), бороздчатый эпителий или карманный эпителий или другие виды бактерий, которые прикрепляются к ним поверхности (Socransky, Haffajee, 1991).Бактериальная адгезия продемонстрировала специфичность задействованных механизмов, и исследования показали, что существует множество рецепторов на поверхности зубов, эпителиальных или других клетках-хозяевах и других бактериях. Недавние исследования описали бактериальные комплексы, которые присутствуют в поддесневом налете, и эти исследования, вероятно, помогут в нынешнем понимании сложной экологии, наблюдаемой в биопленке зубного налета (Socransky, Haffajee et al. 1998). Бактериальные взаимодействия играют важную роль в выживании видов.Некоторые межвидовые отношения являются благоприятными, поскольку один вид производит факторы роста для другого вида или способствует прикреплению другого вида. Другие отношения являются антагонистическими из-за конкуренции за питательные вещества и участки связывания или из-за производства веществ, которые ограничивают или предотвращают рост других видов (Socransky and Haffajee, 1991). Обсуждается ряд различных бактериальных взаимодействий в биопленке зубного налета. За последние 30-40 лет было опубликовано огромное количество доказательств того, что бактерии являются основными этиологическими агентами заболеваний пародонта.В 1950-х и начале 1960-х годов лечение пародонта основывалось на гипотезе неспецифического налета. Однако гипотеза неспецифического налета уступила место после того, как исследования показали, что не все организмы в зубном налете в равной степени способны вызывать деструктивные заболевания пародонта. Таким образом, снова возникла концепция специфичности. Критерии для определения пародонтальных патогенов были разработаны и включают ассоциацию, устранение, реакцию хозяина, факторы вирулентности, исследования на животных и оценку риска (Haffajee and Socransky 1994).До недавнего времени существовало несколько единодушных патогенов пародонта, и попытка отличить патогенные от непатогенных видов была сложной задачей для стоматологов по целому ряду причин. Было представлено обсуждение специфической микробиоты, связанной с гингивитом, хроническим и агрессивным пародонтитом, NUG, ВИЧ-ассоциированным пародонтитом и имплантитом. Бактерии, связанные с заболеваниями пародонта, являются преимущественно грамотрицательными анаэробными бактериями и могут включать A. actinomycetemcomitans, P.gingivalis, P. intermedia, B. forsythus, C. rectus, E. nodatum, P. micros, S. intermediateus и Treponema sp. Количество бактерий, связанных с заболеванием, до 10 (5) раз больше, чем количество бактерий, связанных со здоровьем.
Заболевания пародонта | Заболевания полости рта | Отделение гигиены полости рта
Что такое пародонтоз?
Заболевания пародонта в основном возникают в результате инфекций и воспалений десен и костей, которые окружают и поддерживают зубы.На ранней стадии, называемой гингивитом, десны могут опухнуть и покраснеть, а также кровоточить. В более серьезной форме, называемой периодонтитом, десна может отделяться от зуба, может быть потеряна кость, а зубы могут расшататься или даже выпасть. Заболевания пародонта чаще всего встречаются у взрослых. Заболевания пародонта и кариес — две самые большие угрозы здоровью зубов.
В недавнем отчете CDC 1 приводятся следующие данные о распространенности пародонтита в США:
- 47.2% взрослых в возрасте 30 лет и старше страдают той или иной формой пародонтоза.
- Заболеваемость пародонтом увеличивается с возрастом, 70,1% взрослых в возрасте 65 лет и старше страдают пародонтозом.
Это заболевание чаще встречается у мужчин, чем у женщин (56,4% против 38,4%), у тех, кто живет ниже федерального уровня бедности (65,4%), у людей с образованием ниже среднего (66,9%) и у курильщиков (64,2%). )
Причины
Бактерии во рту поражают ткани, окружающие зуб, вызывая воспаление вокруг зуба, ведущее к пародонтозу.Когда бактерии остаются на зубах достаточно долго, они образуют пленку, называемую зубным налетом, которая со временем затвердевает до зубного камня, также называемого зубным камнем. Зубной камень может распространяться ниже линии десен, что затрудняет чистку зубов. Тогда только стоматолог сможет удалить зубной камень и остановить процесс пародонтоза.
Предупреждающие знаки
Следующие признаки являются тревожными признаками заболеваний пародонта:
- Непреодолимый неприятный запах изо рта или неприятный вкус
- Красные или опухшие десны
- Нежность или кровоточивость десен
- Болезненное жевание
- Шатающиеся зубы
- Чувствительные зубы
- Десны, которые отделились от зубов
- Любые изменения в соединении зубов при прикусывании
- Любое изменение посадки частичных протезов
Факторы риска
Определенные факторы повышают риск заболеваний пародонта:
- Курение
- Диабет
- Плохая гигиена полости рта
- Напряжение
- Наследственность
- Кривые зубы
- Основные иммунодефицитные состояния — e.г., СПИД
- Дефектные пломбы
- Прием лекарств, вызывающих сухость во рту
- Мосты, которые больше не подходят
- Женские гормональные изменения, например, при беременности или применении оральных контрацептивов
Профилактика и лечение
Гингивит можно контролировать и лечить с помощью хорошей гигиены полости рта и регулярной профессиональной чистки. Более тяжелые формы заболеваний пародонта также могут быть успешно вылечены, но могут потребовать более обширного лечения.Такое лечение может включать в себя глубокую очистку поверхностей корней зуба под деснами, прием лекарств, прописанных внутрь или помещаемых непосредственно под десны, а иногда и корректирующую операцию.
Чтобы помочь предотвратить или контролировать заболевания пародонта, важно:
- Чистите щеткой и пользуйтесь зубной нитью каждый день для удаления бактерий, вызывающих заболевания десен.
- Посещайте стоматолога не реже одного раза в год для осмотра или чаще, если у вас есть какие-либо из предупреждающих знаков или факторов риска, упомянутых выше.
Если вы не можете позволить себе стоматологическую помощь, вы можете получить помощь через следующие источники:
Что CDC делает в отношении заболеваний пародонта?
CDC в настоящее время работает с ключевыми партнерскими организациями, такими как Американская академия пародонтологии и Американская стоматологическая ассоциация, над улучшением и поддержанием эпиднадзора за заболеваниями пародонта среди взрослого населения США. Усилия CDC включают (1) разработку мер для использования в надзоре за пародонтозом на уровне штата и на местном уровне, (2) повышение достоверности оценок распространенности, полученных из NHANES (Национальное обследование здоровья и питания), за счет повышения точности. протоколов клинических обследований, использованных в этом национальном обзоре, и (3) разработка простых мер для скрининга заболеваний пародонта в клинических условиях.
Чтобы получить дополнительную информацию о деятельности CDC, щелкните по перечисленным ссылкам:
Эке П.И., Торнтон-Эванс Дж., Дай Б.А., Дженко Р. Достижения в эпиднадзоре за пародонтитом: Центры по контролю и профилактике заболеваний, проект по надзору за пародонтологическими заболеваниями. J Periodontol 11 февраля 2012: 1–9. Просмотреть полную иконку textexternal.
Eke PI, Page PC, Wei L, Thornton-Evans G, Genco RJ. Обновление определений случаев для популяционного эпиднадзора за пародонтитом. J Periodontol 16 марта 2012: 1–9. Просмотреть полную иконку textexternal.
Eke PI, Thornton-Evans G, Wei L, Borgnakke WS, краситель BA. Точность протоколов пародонтологического обследования NHANES. J Dent Res 2010; 89 (11): 1208–1213. Просмотр абстрактного внешнего значка.
Подкасты о пародонтальных заболеваниях и диабете
Слушайте сводку: подкаст о заболеваниях пародонта и диабете. Предоставляет ценную информацию о влиянии заболеваний пародонта и их связи с диабетом (длина 1:36).Посмотреть стенограмму.
Слушайте подкаст о заболеваниях пародонта и диабете. Информативное интервью с двумя стоматологами о заболеваниях пародонта, осложнениях диабета и влиянии плохого состояния полости рта на контроль уровня глюкозы в крови (длина 5:33). Посмотреть стенограмму.
Дополнительные ресурсы
Заболевания пародонта (десен): причины, симптомы и лечение. [PDF – 1.26 M] внешний значок. Брошюра для потребителей Национального института стоматологических и черепно-лицевых исследований. Bethesda, MD.Перепечатано в январе 2006 г.
Американская академия пародонтологии внешний значок
Журнальные статьи о заболеваниях пародонта
Номер ссылки
1 Eke PI, Dye B, Wei L, Thornton-Evans G, Genco R. Распространенность пародонтита у взрослых в США: 2009 и 2010 годы. J Dent Res . Опубликовано онлайн 30 августа 2012 г .: 1–7. Просмотреть полную иконку textexternal.
Начало страницы
Как бактериальный налет вызывает заболевание десен и кариес
Наращивание зубного камня и заболевание десен
Те же самые бактериальные кислоты, которые разрушают зубную эмаль, могут вызвать инфекцию тканей десен и костей, окружающих ваши зубы.Если не удалить весь налет с зубов, он превращается в более твердое вещество, известное как зубной камень. В то время как бактериальный налет является причиной заболевания десен, накопление зубного камня дает ему место для роста. Это многослойный эффект: чем больше налета прилипает к зубам, тем больше образуется зубного камня. Таким образом, на зубном камне будет больше налета и так далее!
На первой стадии заболевания десен, также известной как гингивит, десны становятся красными, опухшими и легко кровоточат.Зубной налет, который прилипает к зубу и линии десен, вызывает воспаление вокруг зубов. Если вы позволите налету и зубному камню осесть на линии десен и под деснами, бактериальные токсины атакуют кости и связки, окружающие ваши зубы. Это вызывает более позднюю стадию болезни десен , такую как пародонтит. Существует несколько ключевых аспектов предотвращения кариеса и заболеваний десен, которые мы выделим ниже:
Источники фторидов
Если у вас слабая зубная эмаль, ваши зубы с меньшей вероятностью будут противостоять бактериальным кислотам во рту.Но есть простой способ сохранить зубную эмаль здоровой и крепкой! Вы можете использовать зубную пасту с фтором, чтобы укрепить и защитить эмаль. И спросите своего стоматолога о других источниках фторида для вашей семьи, таких как жидкости для полоскания рта, пищевые добавки или фторированная вода.
Зубная щетка
Экономия на личной гигиене только помешает вам вылечить заболевание десен и кариес, и это начинается с чистки зубов. Бактерии накапливаются быстрее, если их не вымывать регулярно.Мы рекомендуем чистить зубы зубной щеткой с мягкой щетиной не реже двух раз в день. Обратите особое внимание на налет, который собирается вокруг линии десен. Часто меняйте зубную щетку или головку зубной щетки. Изношенные и потертые щетки плохо очищаются, и в них скапливаются старые бактерии — виновник, от которого вы пытаетесь избавиться!
Зубная нить
Чистка межзубных промежутков один раз в день — необходимость! Поскольку ваша зубная щетка не может охватить всю пищу и бактерии, застрявшие между зубами, использование зубной нити или зубной нити для проникновения в эти труднодоступные места помогает бороться с заболеваниями десен и кариесом.Лучшее время для чистки между зубами — перед сном, чтобы во рту было меньше бактерий во время сна. Но если вы предпочитаете делать это утром, это тоже нормально! Хотя использование зубной нити является типичным способом чистки между зубами, некоторые люди находят использование зубной нити неудобным. Спросите своего стоматолога о доступных держателях зубной нити или других устройствах для чистки межзубных промежутков.
Регулярная профессиональная чистка
Бактерии, которые затвердевают, образуя зубной камень, невозможно удалить зубной щеткой.Следовательно, посещение стоматолога и стоматолога-гигиениста для чистки и осмотра также необходимо. Во время этих посещений ваши стоматологи обнаружат и решат любые проблемы с кариесом или деснами на раннем этапе, прежде чем появятся более серьезные стоматологические проблемы.
Здоровое питание
Когда вы уменьшаете потребление углеводов, особенно рафинированного сахара, вы уменьшаете способность бактерий производить кислоты, вызывающие гниение и заболевания десен. Американская стоматологическая ассоциация подчеркивает важность здорового питания с большим количеством цельнозерновых, белков, молочных продуктов, фруктов и овощей.Замените сладкие закуски и напитки сыром, йогуртом и натуральным арахисовым маслом. Это помогает уменьшить количество кислотных атак, которым ваши зубы подвергаются в течение дня.
Бактериальный налет — плохой парень, когда дело касается стоматологических заболеваний. Вы уже знаете это, так как вкладываете время, усилия и заботу, чтобы сохранить здоровье себя и своей семьи. Но полезно знать, каким образом налет, а затем и зубной камень могут привести к кариесу и заболеванию десен. Мы верим, что знания — сила! Чем больше вы знаете о профилактических мерах, которые вы контролируете, тем больше вероятность, что вы их примените! Благодаря активному уходу за полостью рта, постоянному посещению стоматологов, правильному питанию и использованию подходящих продуктов, знайте, что вы делаете все, что в ваших силах, чтобы ваш рот оставался здоровым и ярким!
Пародонтальные патогены высокого риска вносят вклад в патогенез атеросклероза
Предпосылки
Бактериемия, вызванная микробами из полости рта, была подробно описана в публикации 1954 года.Важное исследование показало, что системное распространение микробов полости рта происходит часто. Обнаруженная частота встречаемости составила 40% при чистке пародонта, 35% при удалении зубов, 24% при чистке зубов и до 17% при жевании1. Распространение этих бактерий полости рта по всему телу происходит быстро. Это приводит к острому и хроническому воспалению, которое может быть патологическим. Пародонтальные патогены с высоким риском включают Aggregatibacter actinomycetemcomitans ( Aa ), Porphyromonas gingivalis ( Pg ), Tannerella forsythia ( Tf ), Treponema denticola obum (
099 Tf ) и
0 Tubicola dicola (
0 Tf). ( Fn ).Они часто встречаются при пародонтите. Эти микробы попадают в системный кровоток напрямую, а также производят эндотоксины, такие как липополисахариды (ЛПС). Эти эндотоксины генерируют воспалительные цитокины, активируют молекулы эндотелиальной адгезии и вызывают протромботическую среду. Эти действия могут способствовать формированию артериального заболевания и могут повышать риск атеротромботического события2. Используя ДНК для идентификации предполагаемых бактерий полости рта, в нескольких исследованиях было документально подтверждено их присутствие в атероме.В 2009 году 44 пациентам была выполнена коронарная эндартерэктомия. Тридцать девять человек страдали пародонтозом (БП). Тридцать шесть образцов, взятых у пациентов с БП, оказались положительными на патогены полости рта. Наиболее распространенными были Pg и Aa . Шестьдесят четыре процента этих атером имели два или более патогенов. Только в одной атероме от пациента без БП были обнаружены какие-либо оральные патогены.3 В 2011 году 42 образца каротидной эндартерэктомии были проанализированы на ДНК орального патогена. У каждой атеромы был по крайней мере один патоген, а у многих было несколько патогенов.Опять же, наиболее распространенными бактериями были Pg и Aa .4 Возбудители болезней полости рта вызывают бактериемию, и эти бактерии, особенно микробы высокого риска, часто связаны с атеросклеротическими поражениями.
Американская кардиологическая ассоциация (AHA) заявила после обширного обзора литературы, что БП независимо связана с артериосклеротическим сосудистым заболеванием (ASVD). Эта взаимосвязь была продемонстрирована доказательствами уровня А. В своем заявлении они обсудили несколько вероятных механизмов, с помощью которых БП может быть связана с артериальным заболеванием.Одно из объяснений связано с системным воспалением, которое может возникать при пародонтите. Это было подтверждено повышенными уровнями биомаркеров, таких как высокочувствительный C-реактивный белок, фактор некроза опухоли-α (TNF-α) и интерлейкин 6. PD был связан со стимуляцией врожденной иммунной системы через толл-подобные рецепторы. (TLR). TLR могут запускать активацию ядерного фактора κβ (NF-κB), который может создавать повышенные уровни молекул адгезии, стимулирующих эндотелиальную дисфункцию, а также повышенные воспалительные цитокины.Была упомянута возможность того, что ЛПС и белки теплового шока, исходящие от патогенов БП, вызывают реакцию аутоиммунного типа со стороны Т- и В-клеток. Другой обсуждаемый потенциальный механизм — прямое повреждение артерий бактериями в кровотоке. Они признали, что есть исследования, показывающие, что терапия ПД улучшила биомаркеры системного воспаления и даже суррогатные показатели субклинического артериального заболевания. Однако из-за того, что нет определенных доказательств, подтверждающих утверждение о том, что лечение БП снижает сердечно-сосудистые (СС) события, AHA продолжило комментировать, что БП не может считаться причиной ASVD.5 С клинической точки зрения, существует значительная разница между тем, чтобы быть связанным с заболеванием или быть причиной заболевания. Оптимальное лечение связанного состояния может не повлиять на окончание болезни, тогда как такое лечение причинного состояния будет иметь благоприятный эффект на окончание болезни. С тех пор, как AHA представило свое заявление о связи БП с ASVD, появились новые доказательства, которые утверждают, что БП, вызванная патогенами высокого риска, Aa , Pg , Tf , Td или Fn , может усиливают элементы триады патогенеза атеросклероза.Благодаря этим научным знаниям, болезнь Паркинсона, вызванная этими предполагаемыми бактериями, может считаться причиной ASVD. Это важное клиническое различие, которое означает, что БП, вызванная этими микроорганизмами, следует оптимально лечить, чтобы снизить риск ASVD.
Недавние публикации показывают, что формирование атеросклероза зависит от трех основных факторов: концентрации липопротеинов в сыворотке, проницаемости эндотелия и связывания липопротеинов в интиме.6 Если заболевание может влиять на все эти критические элементы таким образом, чтобы способствовать патогенезу атеросклероза, можно сделать вывод, что это одна из причин ASVD.Способствующая причина не требует, чтобы все те, у кого есть сопутствующая причина, испытали болезнь, и не требует, чтобы все те, кто свободен от сопутствующей причины, были свободны от болезни. Это также означает, что сопутствующая причина может не быть обязательной для возникновения заболевания.7 PD независимо ассоциируется с ASVD; В настоящее время существуют существенные доказательства и механистическое понимание, которые убедительно свидетельствуют о том, что БП, вызванная вышеуказанными патогенами высокого риска, является одной из причин ASVD. Здесь мы представляем краткое изложение этих свидетельств и понимания.Основываясь на этих выводах, БП, вызванная патогенами высокого риска, следует рассматривать как причину ASVD.
Патогенез, часть 1: концентрация липопротеинов в сыворотке крови
Частицы атерогенных липопротеинов неоднородны и содержат различные количества холестерина. Каждая частица имеет на своей поверхности аполипопротеин B (ApoB). Wilkins et al. 6 недавно продемонстрировали, что концентрация ApoB в сыворотке более предсказуема для патогенеза ASVD, чем концентрация холестерина в сыворотке.В дополнение к этому исследованию, предыдущие исследования также показали, что лучшим липопротеидным прогностическим фактором риска сердечно-сосудистых заболеваний является ApoB. 8–10 Существует прямая положительная и независимая связь с концентрацией ApoB и небольшими плотными концентрациями липопротеинов низкой плотности (sd-LDL). .11 Следовательно, важный элемент патогенеза ASVD, а именно концентрация ApoB, увеличивается с повышением уровней sd-LDL. Секреторная фосфолипаза A2 (sPLA2) преобразует ЛПНП в sd-LDL.12 Было показано, что активность sPLA2 увеличивается у субъектов с пародонтальными патогенами высокого риска Aa , Pg , Tf и Td .Чем выше нагрузка этих патогенов, тем выше активность sPLA2.13 Генерализованная агрессивная БП связана с предполагаемыми патогенами Pg и Aa .14 Показано, что у пациентов с генерализованным агрессивным пародонтитом концентрация sd- ЛПНП по сравнению с субъектами без PD.15 По сути, это означает, что концентрация ApoB удваивается. БП, вызванная патогенами высокого риска, может увеличивать концентрацию ApoB в плазме, что будет способствовать патогенезу ASVD.
Патогенез, часть 2: проницаемость эндотелия
Для образования атеромы необходимы моноциты вместе с липопротеинами, чтобы проникнуть в эндотелий. Именно накопление липопротеинов в интиме формирует ядро атероматозного поражения. Проницаемость эндотелия является критическим фактором в патогенезе ASVD.16 Дисфункциональный эндотелий становится более проницаемым. Предполагается, что эндотелиальная дисфункция является исходным биологическим заболеванием, ведущим к ASVD.17 PD может вызывать эндотелиальную дисфункцию несколькими механизмами. Грамотрицательные патогены высокого риска ( Aa , Pg , Tf , Td ) генерируют ЛПС, которые запускают врожденную иммунную систему. LPS стимулируют TLR, которые встречаются повсеместно и присутствуют в эндотелиальных клетках. Передача сигналов TLR активирует генетический фактор транскрипции NF-κB. Это, в свою очередь, приводит к повышенным уровням молекул адгезии эндотелиальных клеток и TNF-α.18 Молекулы клеточной адгезии захватывают моноциты и увеличивают проницаемость эндотелия.19 Известно, что TNF-α индуцирует повышенную проницаемость эндотелия за счет своего воздействия на белки плотных контактов.20 Хронические инфекции пародонта с патогенами высокого риска могут привести к повышенной проницаемости эндотелия через врожденную иммунную систему.
Существует несколько других механизмов, с помощью которых PD может генерировать дисфункциональный и проницаемый эндотелий. Целостность эндотелия зависит от его эндогенной способности к восстановлению. Постоянное воздействие воспаления приводит к старению эндотелиальных клеток и их отслоению с последующим повышением проницаемости.Это неблагоприятное повреждение можно исправить репликацией соседних эндотелиальных клеток или образованием новых зрелых эндотелиальных клеток из эндотелиальных клеток-предшественников.21 Патоген высокого риска БП ( Aa ) продуцирует токсичный белок, известный как лейкотоксин (LtxA). Было показано, что этот токсин вызывает апоптоз эндотелия наряду с нарушением пролиферации и увеличением молекул эндотелиальной адгезии. 22 Эти неблагоприятные эффекты LtxA приводят к повышенной проницаемости эндотелия.
PD может нарушать структурную связь эндотелиальных клеток.Белки кадгерина плотно блокируют эндотелиальные клетки. Любое нарушение эндотелиального кадгерина приведет к эндотелиальной дисфункции и повышенной проницаемости. 23 Патоген PD Fn обладает молекулой поверхностной адгезии, называемой FadA. Есть две формы FadA. Один из них представляет собой несекретируемый пре-FadA, состоящий из 129 аминокислот, а другой — секретируемый зрелый FadA (mFadA), состоящий из 111 аминокислот. Pre-FadA закреплен на мембране Fn , а mFadA экспонируется на поверхности бактерий.Вместе они образуют высокомолекулярный комплекс, который может присоединяться к эндотелиальному кадгерину, что вызывает перемещение кадгерина от межклеточных соединений. Это приводит к тому, что эндотелий настолько проницаем, что даже бактерии могут проходить через него.24 Патогены БП высокого риска могут увеличивать проницаемость эндотелия с помощью нескольких механизмов.
Патогенез, часть 3: связывание липопротеинов в интиме
Третье требование для патогенеза ASVD — связывание липопротеинов в интимном слое артериальной стенки.Исследования перфузии с использованием меченых липопротеинов показывают, что большинство липопротеинов, проникающих в эндотелий, диффундируют через все слои и отталкиваются на адвентициальной стороне. Количество удерживаемых липопротеинов в интиме на несколько порядков меньше количества частиц, которые диффундируют через артериальную стенку.25 Следовательно, удержание липопротеинов в интиме является жизненно важным шагом в патогенезе ASVD. Тип липопротеинов, захваченных стенкой, не так важен, как количество удерживаемых липопротеинов.Связывание происходит за счет электростатических сил с протеогликанами, находящимися во внеклеточном матриксе (ЕСМ) интимы. Протеогликаны имеют отрицательно заряженные участки, которые связываются с положительно заряженными участками аминокислот на ApoB. На ApoB-100 есть два сайта прикрепления, один из которых экспонируется только в частицах sd-LDL. На ApoB-48.26 имеется один сайт прикрепления.
Гладкомышечные клетки (SMC) имеют два фенотипа. Один из них — сократительный фенотип, обнаруживаемый в медиальном слое артериальной стенки.Другой — синтетический фенотип, который мигрирует из медиального слоя в интимный слой. Синтетические SMC создают обогащенный протеогликаном ECM в интиме.27 Исследования показывают, что синтетические SMC являются первыми клетками интимы, присутствующими в местах, предназначенных для развития ASVD.28 Известно, что микробная инфекция стимулирует генетическую транскрипцию сократительных SMC в синтетические SMC.29 к патогену высокого риска Pg , как было показано, влияет на уровни ангиопоэтина 1 (Angpt1) и ангиопоэтина 2 (Angpt2) в SMC. P. gingivitis создает более высокие уровни Angpt2, что стимулирует генетическую трансформацию SMC в синтетический фенотип. Zhang и соавт. 30 пришли к выводу, что это еще один механизм, с помощью которого пародонтит связан с ASVD. PD может увеличивать связывание липопротеинов в интиме за счет увеличения количества протеогликанов в интиме ECM.
Обсуждение
PD, вызванный патогенами высокого риска, может облегчить три важнейших этапа патогенеза ASVD (рис. 1).Следовательно, разумно, чтобы БП, вызванная патогенами высокого риска ( Aa , Pg , Td , Tf , Fn ), считалась причиной ASVD на клинических основаниях. Поскольку ASVD представляет собой сложный многофакторный процесс заболевания, БП, вызванная патогенами высокого риска, является одной из причин. Это означает, что такая БП не является ни необходимой, ни достаточной для патогенеза ASVD.7 Для целей клинического ведения необходимо поднять различие БП до причинной, а не просто ассоциированной.Причинно-следственная классификация требует, чтобы терапия снижала риск ее эффекта. В этом случае это означает, что БП, вызванная этими микробами высокого риска, необходимо эффективно лечить, чтобы снизить риск ASVD.
Рисунок 1Атерогенная триада в присутствии и отсутствии пародонтальных патогенов высокого риска. Столбец A: Иллюстрация атерогенной триады. (1) Концентрация липопротеинов в сыворотке, каждый из которых содержит ApoB. (2) Дисфункция и проницаемость эндотелия, которые позволяют моноцитам прилипать к эндотелию и проникать в интиму вместе с липопротеидами.(3) Связывание ApoB с протеогликанами, происходящими из мигрирующих SMC, а также превращение моноцитов в макрофаги, которые становятся пенистыми клетками. Столбец B: иллюстрация того, как пародонтальные патогены высокого риска неблагоприятно усиливают каждый из трех элементов, вызывая более выраженный атерогенез. (1) При наличии патогенов высокого риска концентрация ApoB увеличивается. (2) В присутствии патогенов высокого риска эндотелиальная дисфункция и проницаемость усиливаются LPS. (3) В присутствии патогенов высокого риска связывание липопротеинов усиливается за счет увеличения мигрирующих SMC, которые обогащают интиму протеогликанами.АпоВ, аполипопротеин В; ЛПНП, липопротеины низкой плотности; ЛПС, липополисахариды; sdLDL, маленькие плотные LDL; SMC, гладкомышечные клетки.
Как это часто бывает в науке, новое осознание создает список нерешенных вопросов. В этом случае возникает очевидный вопрос, как объективно идентифицировать возбудителей болезней. Определение БП должно включать диагностику конкретных основных патогенов, вызывающих БП. Существуют многочисленные исследования, которые продемонстрировали, что риск сердечно-сосудистых заболеваний от БП определяется бременем патогенов, а не только результатами клинических исследований, такими как глубина кармана, кровотечение при зондировании и потеря костной массы.31–33 Клиническое обследование полости рта важно и должно оставаться важным компонентом диагностики. Однако с точки зрения сердечно-сосудистых заболеваний должна быть объективная оценка патогенного бремени высокого риска как часть определения БП. Существует несколько тестов на оральные патогены на основе ДНК для оценки патогенов высокого риска. Однако многие стоматологи не знакомы с этими тестами, и это требует значительных затрат. Понимание того, что патогены БП высокого риска являются причиной ASVD, возлагает на наших коллег-стоматологов ответственность за продолжение их усилий по разработке доступных, воспроизводимых, объективных тестов на патогены БП высокого риска.
Еще одна существенная проблема, связанная с признанием болезни Паркинсона, вызванной патогенами высокого риска, как причины ASVD, заключается в следующем: как это успешно лечить? Данные о наиболее эффективном способе борьбы с таким заболеванием немногочисленны. В одном рандомизированном проспективном исследовании 101 пациента с БП была проверена эффективность только масштабирования и корневого планирования (SRP) по сравнению с SRP плюс системными антибиотиками. Было две группы антибиотиков: метронидазол (МТЗ) 400 мг 3 раза в день или МТЗ + амоксициллин (AMX) (500 мг 3 раза в день) в течение 14 дней.Кроме того, половина пациентов в каждой из трех групп терапии полоскалась 0,12% хлоргексидином два раза в день в течение 2 месяцев. Контрольное тестирование на патогены завершено через 1 год. Исследование показало, что более эффективное устранение патогенов высокого риска происходит с добавлением антибиотиков и антимикробных полосканий. Однако они указывают на то, что исследование могло быть недостаточно мощным, и любые выводы следует интерпретировать с осторожностью.34 Было проведено еще одно рандомизированное плацебо-контролируемое клиническое испытание, в котором сравнивалась эффективность одного SRP с SRP с антибиотиками MTZ и AMX.В этом исследовании приняли участие 58 некурящих людей с диабетом 2 типа. Их лечили только SRP или MTZ 400 мг и AMX 500 мг три раза в день в течение 14 дней. Последующая оценка ДНК патогенов высокого риска была завершена через 1 год. У пациентов, получавших антибиотики, наблюдалось большее снижение трех патогенов высокого риска: Tf , Td , Pg . Опять же, это очень небольшое исследование, и результаты следует интерпретировать с осторожностью35. Проблемы с лечением выходят за рамки простой начальной терапии патогенов высокого риска.Как наиболее эффективно поддерживать здоровье пародонта? Насколько нам известно, нет значительных опубликованных исследований, посвященных этой актуальной проблеме. Исследования, оценивающие лечение, также должны будут уточнить процент успеха, побочные эффекты терапии, стоимость лечения и, в конечном итоге, окупаемость инвестиций в снижение смертности и заболеваемости ASVD. В настоящее время нет крупных клинических испытаний, дающих окончательный ответ для эффективного лечения БП, вызванного патогенами высокого риска.Это плодородная почва для исследований для наших коллег-стоматологов. Осознание БП из-за патогенов высокого риска как причины ASVD требует такого исследования.
Должно быть ясно, что одна из причин, по которой метаанализ AHA смог доказать только независимую связь БП с ASVD, а не причинно-следственную связь, заключается в небольшом количестве исследований, включающих патогенную нагрузку в определение БП. остается важной проблемой, поскольку опубликованные в настоящее время исследования анализируют взаимосвязь между PD и ASVD.36–38 Когда компонент патогенов высокого риска включен в диагностику БП, есть доказательства того, что лечение снижает риск сердечно-сосудистых заболеваний. Изменение утолщения интимы сонной артерии (cIMT) является маркером изменения риска сердечно-сосудистых заболеваний. Лечение патогенов высокого риска положительно повлияло на cIMT.39 Учитывая современные научные доказательства того, что именно патогены высокого риска БП определяют риск сердечно-сосудистых заболеваний, крайне важно, чтобы протоколы исследований включали бремя конкретных патогенов в качестве неотъемлемого элемента определение БП и то, что терапевтическое воздействие исследует изменение бремени патогенов высокого риска.Можно было бы ожидать, что результаты таких исследований будут совместимы с патогенами высокого риска, способствующими развитию ASVD.
ASVD остается причиной номер один смертности и заболеваемости в этой стране.40 Текущая литература подтверждает, что более экономично предотвратить ASVD, чем лечить его осложнения.41 У артериальных заболеваний есть общая основная причина — воспаление42. Существует множество состояний, которые могут вызвать воспаление артерий. В список входят: липиды, курение, гипертония, инсулинорезистентность, дефицит витамина D, обструктивное апноэ во сне, ожирение, диета, отсутствие физической активности, психосоциальные проблемы, проблемы со здоровьем полости рта, системные воспалительные состояния, такие как ревматоидный артрит, волчанка, генетические факторы и системные заболевания. инфекционное заболевание и дисбактериоз кишечника.43–57. Теперь у нас есть доказательства того, что БП может вызывать системное воспаление, а также может отрицательно влиять на три основных механизма патогенеза ASVD. Необходимо классифицировать БП, вызванную патогенами высокого риска, как причину ASVD. Этот тип БП представляет собой заболевание, связанное с лечением зубов. В настоящее время наши коллеги-стоматологи не выяснили окончательного способа успешного лечения этого типа БП. Путь ясен для обоснования того, что БП, вызванная патогенами высокого риска, является причиной ASVD.После того, как наши партнеры в области здравоохранения в стоматологии определили эффективное лечение этого типа БП, такое вмешательство предлагает значительный потенциал для снижения воздействия ASVD.58
Основные сообщения
Заболевания пародонта (БП), вызываемые патогенами высокого риска, могут отрицательно влиять на триаду патогенеза атеросклероза.
БП, вызванная патогенами высокого риска, может считаться сопутствующей причиной артериального заболевания.
Стоматологическое сообщество имеет значительную возможность смягчить причину номер один заболеваемости и смертности, а именно сердечно-сосудистые заболевания, путем выяснения возможного эффективного лечения БП, вызванного патогенами высокого риска.
Текущие вопросы исследования
В этом обзоре указывается на необходимость проведения проспективных исследований, в которых будут рассмотрены следующие запросы:
Проспективные рандомизированные исследования необходимы для определения эффективного лечения заболеваний пародонта (БП), вызванных патогенами высокого риска. Эти исследования должны также учитывать стоимость такого лечения, а также побочные эффекты, долгосрочную эффективность и пользу с точки зрения смягчения сердечно-сосудистых событий.
У пациентов с болезнью Паркинсона успешная эрадикация патогенов высокого риска снижает уровень аполипопротеина B?
При использовании меченых липопротеинов в исследовании перфузии артериальной стенки различается ли количество удерживаемых в интиме липопротеинов до и после терапии патогенов БП высокого риска?
Ключевые ссылки
Cobe HM.Преходящая бактериемия. Oral Surg Oral Med Oral Pathol 1954; 7: 609–15.
Фигеро Э., Санчес-Бельтран М., Куэста-Фрехосо С., и др. . Обнаружение пародонтальных бактерий в атероматозной бляшке с помощью вложенной полимеразной цепной реакции. J Periodontol 2011; 82: 1469–77.
Гаэтти-Жардим Э. мл., Марселино С.Л., Фейтоса А.С., и др. . Количественное определение пародонтопатических бактерий в атеросклеротических бляшках коронарных артерий. J Med Microbiol 2009; 58 (Pt 12): 1568–75.
Li X, Kolltveit KM, Tronstad L, и др. . Системные заболевания, вызванные инфекцией полости рта. Clin Microbiol Rev 2000; 13: 547–58.
Чжан Б., Халаф Х., Сирсджо А., и др. . Гингипаины пародонтального патогена Porphyromonas gingivalis играют важную роль в регуляции ангиопоэтина 1 и ангиопоэтина 2 в клетках гладких мышц аорты человека. Infect Immun 2015; 83: 4256–65.
Вопросы для самооценки (Верно / Неверно)
Уровень Доказательства демонстрируют, что заболевания пародонта независимо связаны с атеросклеротическим заболеванием сосудов.
Сопутствующая причина не требует, чтобы все те, кто обладает способствующей причиной, испытали следствие, а также не требует, чтобы все те, кто свободны от способствующей причины, были свободны от следствия.
Заболевания пародонта, вызываемые патогенами высокого риска, могут играть непосредственную роль в триаде состояний, влияющих на патогенез атеросклероза.
Пародонтологические патогены высокого риска не могут влиять на концентрацию липопротеинов в сыворотке или проницаемость эндотелия.
Пародонтальный патоген высокого риска Porphyromonas gingivalis может способствовать превращению сократительных гладкомышечных клеток в мигрирующие синтетические гладкомышечные клетки, которые могут усиливать связывание липопротеинов в интиме.
Приложение
Ответы
Верно
Верно
Верно
Ложно
Истинно
Неинвазивная фотодинамическая терапия
—Неинвазивная фотодинамическая терапия Бактериальные штаммы и условия культивирования
Porphyromonas gingivalis (P . gingivalis ; ATCC 33277) и Fusobacterium nucleatum (F . nucleatum ; ATCC 25586), которые являются частыми возбудителями пародонтита, были получены из Корейской коллекции типовых культур (KCTC, Тэджон, Корея). П . gingivalis и F . nucleatum инкубировали на чашке с агаром, обогащенной триптическим соевым бульоном (Becton, Dickinson, and Company, MD, США), содержащим 5% овечьей крови (Komed, Seongnam-si, Корея), 5 мкг / мл гемина (Sigma Aldrich, Миссури, США) и 0.1 мкг / мл менадиона (витамин K1) (Sigma Aldrich, Миссури, США) в течение 48–72 ч при 37 ° C на анаэробной рабочей станции. Затем бактериальную колонию ресуспендировали в 5 мл суспензионного раствора при 37 ° C в течение 48–72 часов. Количество клеток регулировали с помощью спектрофотометра (Ultrospec 3000pro, Amersham-Pharmacia, Uppsala, Швеция) при длине волны 540 нм ( P . gingivalis : 1 × 10 10 клеток / мл; F. . nucleatum : 1 × 10 6 клеток / мл). 100 мкл образца скорректированной бактериальной суспензии помещали в лунки 96-луночного стрип-иммунопланшета (SPL Life Sciences, Gyeonggi-do, Корея) для фотодинамической активации.
Исследования фотодинамической активации
Все эксперименты проводились в темной комнате. ТВО в виде порошка (Sigma Aldrich, Миссури, США) растворяли в фосфатном физиологическом растворе (PBS). В лунки добавляли пять мкл различных концентраций растворов ТВО для получения конечных концентраций 0,16, 0,33 и 0,98 мМ. После 5 мин инкубации лунки, содержащие ТВО (общий объем 100 мкл), освещали светодиодной подсветкой. Использовали светодиодный прибор (MK3003D, MKPOWER, Сеул, Корея: выходная мощность 90 мВт) с длиной волны 650 нм.Светодиодный светильник доставляется с помощью специального адаптера и оптоволоконного кабеля. Плотность мощности, проходящей через скважины, составляла 3, 30 и 60 мВт / см 2 соответственно. Продолжительность облучения составляла 1 мин 5 мин. TBO-отрицательные контроли инкубировали с равным объемом забуференного фосфатом физиологического раствора (PBS). Расстояние между светодиодом и пластиной составляло 1 см. После облучения светодиодами все суспендированные бактерии помещали на чашку с агаром и инкубировали при 37 ° C в течение 48–72 ч в соответствии с условиями инкубации.Затем бактериальные колонии подсчитывали и переводили в Log 10 КОЕ / мл.
Чтобы проверить, проникает ли светодиодный свет с длиной волны 650 нм через ткани, которые по толщине аналогичны тканям десен, и активирует ли бактерицидный эффект TBO, была проведена искусственная кожа толщиной 3 мм (Geistlich Mucograft®, Geistlich Pharma, NJ, USA). помещается между светодиодным устройством и бактериальной суспензией. Эксперименты по проникновению светодиода проводили таким же образом, как описано выше.
Антибактериальную активность составов ТВО оценивали следующим образом. Состав, содержащий 75 мМ ТВО, включенный в Твин 60 (TW60_F), осторожно перемешивали с помощью магнитной мешалки при 150 об / мин в культуральной среде в течение 0 минут, 15 минут и 3 часов, а затем смесь добавляли в лунки для культивирования для получить конечную концентрацию ТВО 0,33 мМ. После 5-минутной инкубации лунки подвергали воздействию 60 мВт / см 2 LED на длине волны 650 нм в течение 1 и 5 минут. Затем отрицательные контроли для TW60_F инкубировали с равным объемом PBS.Расстояние между светодиодом и пластиной составляло 1 см, и все эксперименты проводились в темной комнате. После облучения светодиодами все бактериальные клетки в 96-луночном планшете распределяли на планшете с триптическим соевым агаром и инкубировали при 37 ° C в течение 48–72 ч в соответствии с условиями инкубации. После инкубации бактериальные колонии подсчитывали и переводили в Log 10 КОЕ / мл.
Определение разрушения биопленки
Бактериальная биопленка формировалась на 96-луночных микротитровальных планшетах (SPL Life Sciences, Кенги-до, Корея). П . gingivalis и F . nucleatum инкубировали в покрытых слюной 96-луночных стрип-иммунопланшетах при 37 ° C в течение 48–72 ч на анаэробной рабочей станции. Для покрытия 96-луночного стрипа иммунопланшета у здоровых людей собирали слюну и смешивали с 1 × PBS (1: 9 об. / Об.) Для центрифугирования в течение 10 мин при 3000 об / мин при 4 ° C. Протокол исследования и экспериментальный план сбора слюны у здоровых людей были одобрены стоматологической больницей Университета Вонкванг IRB, идентификатор утверждения: WKDIRB201708-01.Супернатант фильтровали, используя шприц 0,22 мкм; 96-луночные стрип-иммунопланшеты покрывали при 4 ° C в течение 4 ч, а затем хранили при 4 ° C до использования. Образовавшуюся биопленку обрабатывали ФДТ через искусственную кожу толщиной 3 мм в соответствии с тем же протоколом и инкубировали в течение 24 часов в тех же условиях инкубации, которые описаны выше в разделе исследований фотодинамической активации.
Для окрашивания кристаллическим фиолетовым супернатант культуры отбрасывали, а лунки дважды промывали 1 × фосфатно-солевым буфером (1 × PBS).Оставшиеся клетки биопленки, прикрепленные к поверхности полистирола, фиксировали 95% этанолом в течение 10 мин и окрашивали 0,1% кристаллическим фиолетовым в течение 15 мин. Затем планшеты дважды промывали 1 × PBS и сушили на воздухе. Для количественного измерения биопленки связанный кристаллический фиолетовый солюбилизировали 10% ледяной уксусной кислотой в течение 10 мин и определяли OD595 с помощью микропланшетного спектрофотометра (BioTek, St, Winooski, VT, USA).
Приготовление топических составов TBO
Согласно классификации Каца и Ариенса (M.Кац, Э. Ariens (Ed.), Drug design, Academic Press, New York, 1973), лекарство, высвобождающее «абсорбирующую основу» по истечении определенного времени, является подходящей рецептурой для полости рта. Этот состав состоит из масляной фазы, такой как органогель углеводородного типа или гидрофильный органогель, и воды в детергентах масляного типа, и его следует оптимизировать в зависимости от характеристик и назначения лекарственного средства. Композиции состояли из трех основных ингредиентов: толуидинового синего О (Sigma-Aldrich, Миссури, США), поверхностно-активного вещества (Span 80, Span 20 или Tween 60) и мазевой основы (пластибаза).Для тестирования различных предписаний по величине гидрофильно-липофильного баланса (ГЛБ) были выбраны поверхностно-активные вещества Span 80, Span 20 и Tween 60 (Samchun Pure Chemical, Gyeonggi, Республика Корея). Составы ТВО, содержащие разные концентрации ТВО (0,03 мМ или 75 мМ) и ингредиенты, получали следующим образом. Навески ТВО медленно добавляли к поверхностно-активному веществу при осторожном перемешивании. После образования прозрачного вязкого раствора раствор ТВО примешивали к пластибазе, применяя метод геометрического разбавления.После растворения растворимость снижалась по мере того, как раствор ТВО смешивался с основанием, и частицы лекарства формировались «снизу вверх». Размер образовавшихся частиц в однородном состоянии составлял несколько десятков мкм. ТВО реагирует со светом, поэтому он был приготовлен в затемненных условиях. Различные составы ТВО, разработанные с различными композициями, были закодированы следующим образом: 0,03 мМ: SP80_D, SP20_D и TW60_D; и TBO 75 мМ: SP80_F, SP20_F и TW60_F; Таблица 2. Состав препаратов был определен на основании публикации «Drug Design» 24 .
In vitro высвобождение из губки или акриловой пластиныДля оценки высвобождения ТВО из составов, анализы элюции проводили после равномерного нанесения 1,2 г каждого состава на площадь 2,0 см × 2,0 см, на расстоянии 1 см от обоих концов 2 см × Губка размером 4 см или 0,8 г каждого состава на площадь 2,0 см × 2,0 см, на расстоянии 1 см от обоих концов акриловой пластины размером 2 см × 12 см. Мы поместили губку или акриловую пластину в 150 мл элюирующей среды, состоящей из физиологического раствора или смешанной среды (100 мл фосфатно-солевого буфера (PBS) с 50 мл метилового спирта [MeOH]) при 36.5 ° С. Губке давали возможность всплыть, чтобы растворитель мог достичь поверхности мази, и акриловую пластину устанавливали под углом на химическом стакане. Образцы осторожно перемешивали с использованием магнитного вращающегося стержня при 200 об / мин для губки и 150 об / мин для акриловой пластины. Образцы отбирали с интервалами 0, 1, 3, 8, 15, 30, 60, 120 и 180 минут. и спектрофотометрически проанализировали содержание ТВО с использованием детектора ультрафиолетового (УФ) и видимого диапазонов.
In vitro Тест удержания и вязкости лекарственного средстваЧтобы проверить скорость удерживания лекарственного средства в полости рта, был проведен тест удерживания.После проведения эксперимента, описанного выше, образцы акриловых пластин отбирали через 0, 30, 60, 120 и 180 мин. Степень удерживания получали путем взвешивания акриловой пластины после удаления воды из акриловой пластины. Вязкость измеряли с помощью вискозиметра Brookfield DV-II + (Brookfield, США). Состав нагревали от 23,3 ° C ± 0,1 ° C до 30,45 ± 0,96 ° C в мерном цилиндре. Для каждого эксперимента использовали один и тот же шпиндель (шпиндель LV-5) и одинаковую скорость перемешивания (1 об / мин).
Животные и экспериментальная модель пародонтита
Протокол исследования и дизайн эксперимента были одобрены Комитетом по этике животных Университета Вонкван, идентификатор утверждения: WKU17-64.В эксперименте использовали 30 самцов крыс линии Вистар в возрасте 6 недель. Их масса тела в начале эксперимента составляла от 300 до 330 г. Животные были случайным образом разделены на три группы (n = 10): без лигирования; только лигатура; лигатура плюс ФДТ. Индукция пародонтита производилась один раз в неделю в течение 4 недель путем наложения швов и распространения бактерий. Шелковый шов 4-0 накладывали субмаргинально вокруг первого моляра в обоих квадрантах нижней челюсти. Животные получали пероральные прививки свежего 0.1 мл бульона культуры штамма P . десны и F . nucleatum в целевой области десны. После наложения швы проверяли и заменяли потерянные или ослабленные швы. ФДТ проводилась 1 раз в неделю в течение 4 недель. Мазь ТВО наносили на десневую борозду поражения пародонта и оставляли для пропитывания на 10 мин. Десна подвергалась воздействию светодиодного света в тех же условиях, что и in vitro (10 мВт / см, 2 , 650 нм) в течение 5 минут.Еще через 4 недели после последнего лечения ФДТ животных умерщвляли, и нижнюю челюсть отделяли от мышц и мягких тканей, сохраняя прикрепленную десну нетронутой с костью. В то же время были взяты образцы крови животных. Микро-КТ изображения десневой области сканировали четыре раза: один перед индукцией периодонтита и три других в конце каждой фазы (фаза индукции, фаза ФДТ, фаза инкубации). Включая индукцию пародонтита и ФДТ, все процедуры с животными проводились под общей анестезией с использованием кетамина (40 мг / кг) посредством внутрибрюшинной инъекции.Все эксперименты проводились в соответствии с соответствующими инструкциями и правилами.
Микро-КТ-визуализация
КТ-визуализация выполнялась с использованием системы визуализации Quantum GX μCT (PerkinElmer, Хопкинтон, Массачусетс, США), расположенной в Корейском институте фундаментальных наук (Кванджу, Корея). Источник рентгеновского излучения был установлен на уровни 90 кВ и 88 мкА с полем зрения 45 мм (размер вокселя 90 мкм; время сканирования 4 мин). КТ-изображения были представлены с помощью 3D Viewer, существующего программного обеспечения в Quantum GX. Все изображения обычно экспортировались отдельными срезами в файл формата DICOM для медицинских изображений.
Иммуногистохимия
Выделенные срезы тканей декальцифицировали, а затем парафинизировали. Депарафинизированные ткани блокировали 3% H 2 O 2 фосфатно-солевым буфером для инактивации эндогенных пероксидаз. Предметные стекла промывали фосфатно-солевым буфером, инкубировали в течение 20 минут в растворе, блокирующем белок, с добавлением 4% нормального бычьего сывороточного альбумина, инкубировали в течение ночи при 4 ° C с первичными антителами против TNF-α (каталожный номер sc-1351). ИЛ-1β (кат.No. sc-1252) и MMP-9 (Cat. No. sc-6841), которые были приобретены у Santacruz Biotechnology (Калифорния, США). Для разработки DAB использовали набор полимеров Anti-Mouse (Dako, Япония). Ткани контрастировали гематоксилином.
Статистический анализ
Результаты были выражены как средние значения ± стандартное отклонение (среднее ± стандартное отклонение). Двусторонний дисперсионный анализ (ANOVA) выполняли с апостериорным тестированием (тест Тьюки), чтобы определить, были ли существенные различия между условиями тестирования.Для анализа переменных TNF-α в сыворотке выполняли однофакторный дисперсионный анализ ANOVA с апостериорным тестированием, если это необходимо. Статистически значимым считалось значение p <0,05.
Микро-менеджмент оральных бактерий | Доставка лекарств от перио-десен
Из-за неправильного обращения с бактериями полости рта 47% взрослых американцев страдают хроническим заболеванием десен, известным как пародонтит. Еще десятки миллионов болеют гингивитом. Ты один из них? Вы можете иметь заболевание десен и не знать об этом, потому что болезнь трудно увидеть и она не болит на более поздних стадиях.Так много людей страдают заболеванием десен, потому что его так трудно лечить. Заболевание начинается с биопленок (бактериальных сообществ полости рта), которые накапливаются под линией десен, где их невозможно достать с помощью зубных щеток, зубной нити или жидкости для полоскания рта. Даже стоматологи не могут полностью очистить биопленку глубоко под деснами. Антибиотики могут временно помочь, но бактерии часто возвращаются или вырабатывают устойчивость к антибиотикам, и цикл болезни продолжается.
Если вы боретесь с заболеваниями пародонта, пора подумать о более эффективном методе борьбы с бактериями в полости рта — лечении заболеваний десен, которое фактически снижает количество бактериальных инфекций и удерживает их под контролем с течением времени.С Perio Tray ® вы можете эффективно доставлять лекарства для изменения и уменьшения количества биопленок на ежедневной основе для более эффективного и долгосрочного лечения заболеваний. Управление микросредой (бактериями полости рта) является ключом к здоровью десен, и благодаря Perio Protect доставка лекарств теперь стала проще и эффективнее.
Что такое биопленки?
Биопленки — это просто сообщества или колонии бактерий. Рост биопленки в пародонтальных карманах (пространстве между зубом и десной) происходит в три этапа.После первого этапа прикрепления бактериальные клетки начинают образовывать колонию со слизистой защитной оболочкой, отсюда и термин «биопленка» или живая пленка. На втором этапе колония разрастается. Это может привести к инфицированию десен, вызывая кровотечение и воспаление. На наиболее поздней стадии роста биопленки скопления бактерий отделяются, образуя новые сообщества, которые могут вызвать новые инфекции. Если их не лечить, эти инфекции могут привести к потере костной ткани, поддерживающей зубы, и, следовательно, к потере зубов.Инфекционные бактерии также могут распространяться в ваш кровоток и способствовать системным воспалениям и заболеваниям.
Системные заболевания, связанные с бактериями полости рта
© Центр биопленочной инженерии МГУ; используется с разрешения.
Теории, связывающие бактерии полости рта с системными заболеваниями, описывают рот как портал, через который бактерии распространяются в другие области вашего тела. Подобно тому, как бактериальные скопления отделяются от биопленок и образуют новые колонии во рту, эти бактериальные скопления могут иметь эффект «посева» в кровоток.Когда инфекции биопленки вызывают воспаление и язвы (язвы или поражения) в ткани десен, небольшие отверстия в ткани десен могут позволить бактериям проходить из десен в кровоток, и как только это происходит, воздействие бактерий полости рта может быть разрушительным. к другим частям вашего тела. Исследования установили связь между бактериями полости рта и следующими системными заболеваниями:
Диабет 2 типа
Лечение заболеваний десен положительно влияет на диабет, помогая контролировать его последствия.Фактически, пациенты с диабетом и заболеваниями десен часто имеют более высокий уровень сахара в крови, чем пациенты с диабетом с более здоровыми деснами, и им часто требуется больше лекарств для лечения диабета. В исследованиях, когда лечили заболевание десен, у пациентов с диабетом уровень сахара в крови снижался, который оставался ниже в течение трех месяцев.
Болезнь сердца, инсульт, сгустки крови, хроническое воспаление и атеросклероз
Оральные бактерии, попадающие в организм, могут вызывать воспаление артерий.Воспалительная реакция в сочетании с отложениями жира может привести к накоплению зубного налета, который закупоривает кровоток. По мере того, как тромбоциты накапливаются, а кровоток продолжает восстанавливаться, могут образовываться сгустки крови, которые могут привести к сердечным приступам, инсультам, атеросклерозу (затвердеванию артерий) и другим опасным состояниям для здоровья.
Болезни органов дыхания
Бактерии, присутствующие при заболеваниях десен, были обнаружены в ткани легких пациентов с абсцессами легких, что указывает на возможную корреляцию между ними.
Недоношенные дети и дети с низкой массой тела при рождении
Беременные женщины с заболеваниями десен имеют 57% случаев рождения детей с низкой массой тела и на 50% больше случаев преждевременных родов. Исследователи продолжают изучать эти корреляции, чтобы определить связь между заболеванием десен и беременностью.
Болезнь Альцгеймера
Бактерии, связанные с болезнью Альцгеймера, были изолированы в пародонтальных карманах и вдоль нервов от зубов до ткани мозга.Когда эти бактерии вводятся в культуры мозга, образуется бета-амилоид, вещество, связанное с болезнью Альцгеймера.
Колоректальный рак
Распространенные анаэробные бактерии, участвующие в заболеваниях пародонта, были идентифицированы как движущая сила колоректального рака.
Борьба с заболеванием десен может помочь при системных заболеваниях
Пациентам, страдающим любым из этих системных заболеваний, следует обсудить со своим врачом способы защиты своего здоровья. Им также следует поговорить со своим стоматологом, потому что забота о здоровье полости рта способствует улучшению общего состояния здоровья.
Узнайте у стоматолога о подносе Perio Tray от Perio Protect. Исследования показывают, что когда Perio Tray используется для доставки перекиси водорода глубоко под десны, это помогает уменьшить биопленку, кровотечение и глубину карманов. Перекись высвобождает кислород, убивая некоторые бактерии полости рта, но также вызывая изменение микросреды пародонтального кармана, что затрудняет повторное заселение инфекционных бактерий. При ежедневном использовании пациенты могут лучше справляться с заболеваниями десен.
Drs.Suway and Toscano, Зубные имплантаты, косметическая и лазерная пародонтология
Заболевание пародонта — это бактериальная инфекция, поражающая десны и кости, поддерживающие зубы. Токсины, обнаруженные в бактериальном налете, ответственны за воспаление, которое разрушает ткань десен и кости.
При своевременном лечении последствия легкого воспаления (известного как гингивит) полностью обратимы. Однако, если бактериальная инфекция прогрессирует, заболевание пародонта начинает разрушать десны и нижележащую кость челюсти (пародонтит), что приводит к потере зубов.В некоторых случаях бактерии от этой инфекции могут перемещаться в другие части тела через кровоток.
Общие Факторы , способствующие заболеванию десен
Плохая гигиена полости рта — Профилактика стоматологических заболеваний начинается дома с хорошей гигиены полости рта и сбалансированного питания. Профилактика также включает регулярные посещения стоматолога, которые включают осмотры, чистки и рентген. Сочетание хорошего домашнего ухода и профессионального ухода за зубами по-прежнему остается лучшим средством для сохранения естественных зубных рядов и поддерживающих костных структур.Когда бактерии и зубной камень (зубной камень) не удаляются, десны и кости вокруг зубов подвергаются воздействию токсинов бактерий, вызывающих гингивит или периодонтит, что может привести к потере зубов.
- Употребление табака — Хотя употребление табака не вызывает заболеваний пародонта, оно является одним из наиболее важных факторов его развития и прогрессирования. Как курение, так и бездымный табак вызывают прямое раздражение тканей десны и вызывают снижение кровотока, что делает ткани гораздо более восприимчивыми к токсинам бактериального налета.
Генетическая предрасположенность — Несмотря на строгие правила гигиены полости рта, до 30% населения могут иметь сильную генетическую предрасположенность к заболеваниям десен. У этих людей вероятность развития пародонтоза в шесть раз выше, чем у лиц без генетической предрасположенности. Генетические тесты могут использоваться для определения восприимчивости, и может быть выполнено раннее вмешательство, чтобы сохранить здоровье ротовой полости.
Беременность и менопауза — Во время беременности регулярная чистка зубов щеткой и зубной нитью имеет решающее значение.Гормональные изменения, испытываемые организмом, могут сделать ткани десен более чувствительными, что сделает их более восприимчивыми к заболеваниям десен.
Хронический стресс и неправильное питание — Стресс снижает способность иммунной системы бороться с болезнями, а это означает, что бактериальные инфекции с большей вероятностью побьют защитную систему организма. Плохое питание или недоедание также могут снизить способность организма бороться с инфекциями пародонта.
Диабет — Если вы страдаете диабетом, вы подвержены более высокому риску развития инфекций, включая заболевания пародонта.Фактически, заболевание пародонта часто считается шестым осложнением диабета. При отсутствии лечения пародонтоз может повышать уровень сахара в крови, что приводит к увеличению периодов времени, когда организм функционирует с высоким уровнем сахара в крови. Это подвергает диабетиков повышенному риску диабетических осложнений. Диабетикам с заболеваниями пародонта следует лечить, чтобы устранить инфекцию пародонта.
Шлифовка зубов — Сжатие или скрежетание зубов может значительно повредить поддерживающую ткань, окружающую зубы.Скрежетание зубами может быть связано с «плохим прикусом» или смещением зубов. Когда человек страдает нелеченым заболеванием десен, измельчение может ускорить развитие костей и тканей десен.
Лекарство — Многие лекарства, включая оральные противозачаточные таблетки, сердечные лекарства, антидепрессанты и стероиды, влияют на общее состояние зубов и десен; делает их более восприимчивыми к заболеваниям десен.
Доктор.Суэй и доктор Тоскано специализируются на лечении заболеваний десен и установке зубных имплантатов. Они могут выполнять эффективные процедуры «очистки» глубоких карманов, известные как шелушение и выравнивание корней, а также прописывать антибиотики для лечения инфекции и остановки прогрессирования заболевания.
В случае потери костной ткани врачи могут выполнить трансплантацию тканей, чтобы способствовать естественной регенерации тканей, и вставить зубные имплантаты, если зуб или несколько зубов отсутствуют.«Зубастые» или «липкие» улыбки можно лечить с помощью реконтурирования или регенерации тканей десны, чтобы создать ровный и эстетичный вид.
Врачи будут рады устранить причины заболевания десен, чтобы предотвратить возникновение, прогрессирование и рецидив заболевания пародонта.
Если у вас есть какие-либо вопросы или опасения по поводу причин или методов лечения заболеваний десен, звоните по телефону в офис .
Jenkintown Periodontics & Dental Implants, LLC
Dr.Нил Б. Суэй и доктор Джереми Тоскано
Зубные имплантаты, косметическая и лазерная пародонтология
261 Old York Road Suite 319
Jenkintown, PA 19046
Телефон: (215) 887-6060
Удобно для Филадельфии, Абингтон, Уиллоу Гроув, Элкинс Парк, Челтнем, Хоршем, Уорминстер и Хатборо
.
 Самые распространенные бактерии Actinobacillus actinomycetemcomitans. Но могут быть и Prevotella intermedia, Treponema denticola.
Самые распространенные бактерии Actinobacillus actinomycetemcomitans. Но могут быть и Prevotella intermedia, Treponema denticola. 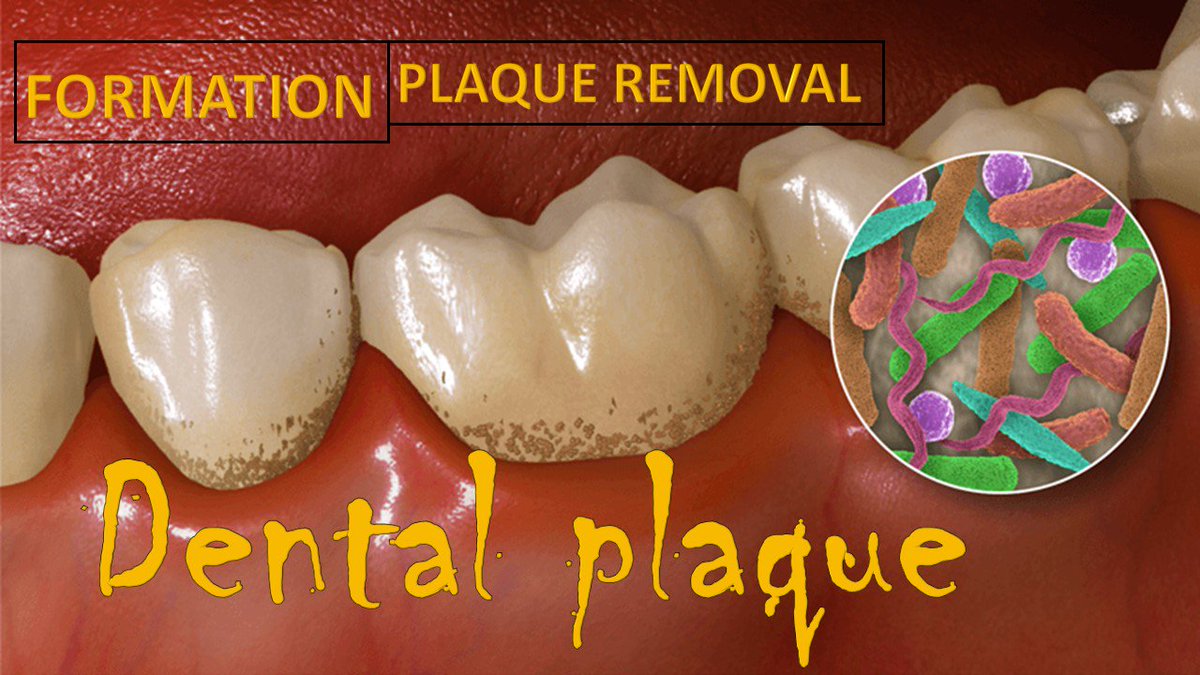 Еще один плюс – минимальное воздействие и “снятие” тканей зубов в сравнении с традиционным, механическим, ротационным способом очищения.
Еще один плюс – минимальное воздействие и “снятие” тканей зубов в сравнении с традиционным, механическим, ротационным способом очищения.