Пародонтопатия что это: Пародонтопатия – лечение заболеваний парадонта.
Пародонтит. Симптомы и причины заболевания.
Прочитав эту статью, Вы узнаете:
— какие бывают симптомы (признаки) пародонтита,
— причины пародонтита.
Пародонтит – это воспаление всех окружающих зуб тканей, сопровождающееся разрушением и убылью косной ткани, а также разрушением зубодесневого прикрепления.
Причины развития пародонтита.
Пародонтит может быть локализованным в области одного или нескольких зубов, а также иметь генерализованный характер (в области всех зубов).
Причины развития локализованного пародонтита:
1. Нависающие края пломб в межзубных промежутках − это приводит к травме межзубных сосочков, а также создает условия для задержки пищевых остатков в таких межзубных промежутках, и как следствие- развитие воспаления,
2. Нависающие края искусственных коронок или мостовидных протезов, травмирующие десну,
3. Плохо изготовленные съемные протезы, травмирующие десну,
4.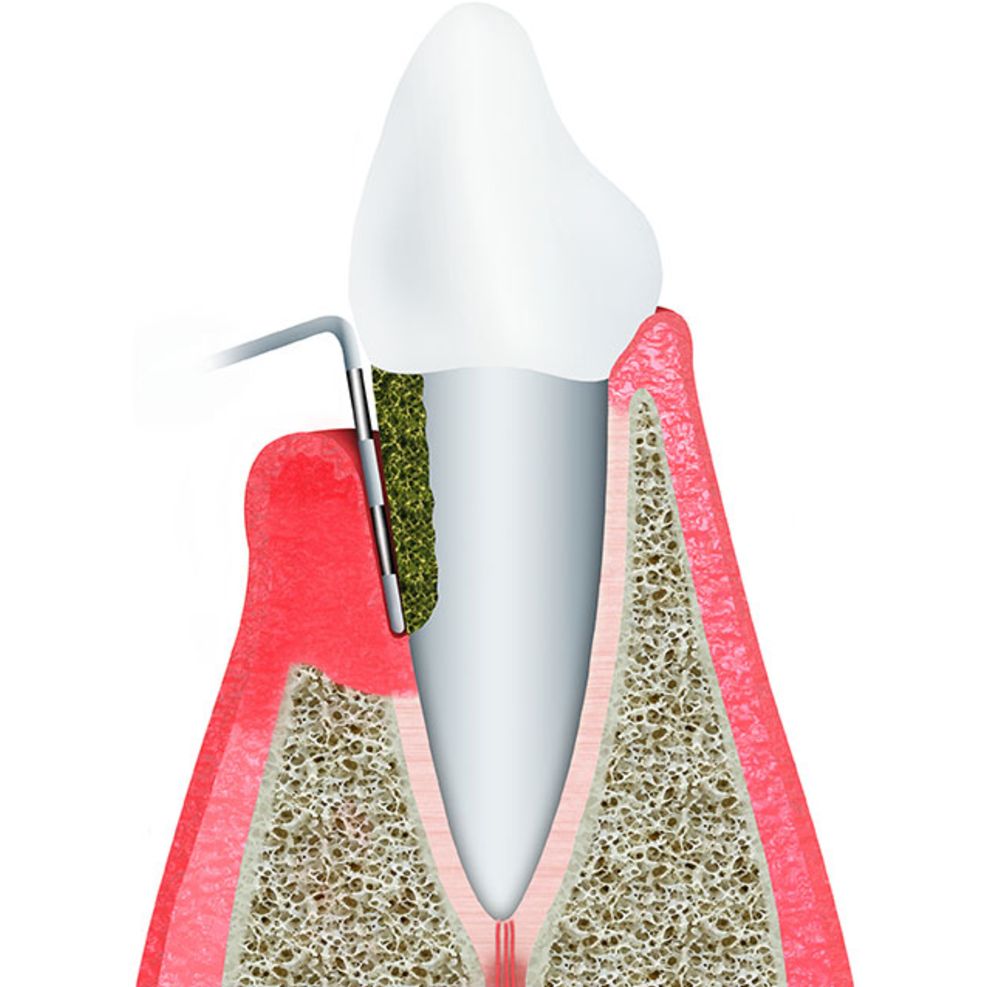
5. Окклюзионная травма (патология прикуса) − когда нагрузка при смыкании зубов распределяется не равномерно на все зубы, а есть участок преждевременного накусывания (суперконтакт). В месте такого суперконтакта зуб испытывает перегрузку, что сопровождается развитием воспаления. Очень часто оклюзионные травмы имеют место быть у пациентов, у которых отсутствует часть зубов.
Причины развития генерализованного пародонтита:
Генерализованная форма пародонтита, т.е. когда воспаление есть в области всех или большинства зубов − развивается вследствие плохой гигиены полости рта, наличия большого количества над и поддесневых зубных отложений. Токсины, выделяемые микроорганизмами зубного налета, запускают цепь воспалительных реакций в деснах, которые приводят к разрушению прикрепления зуба к кости, к разрушению костной ткани и т.д.
Симптомы пародонтита.
Симптоматика локализованной и генерализованной формы пародонтита мало чем отличается друг от друга, разница только в причинах возникновения воспаления и в количестве зубов, у которых развивается воспаление.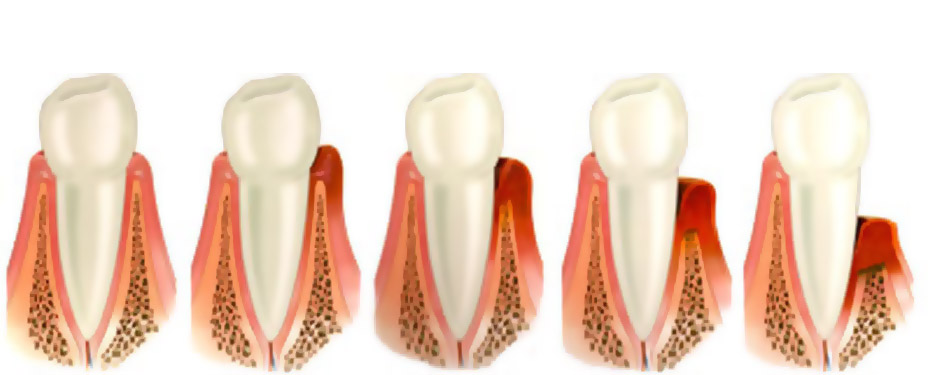 Поэтому мы опишем только генерализованную форму, как наиболее часто встречающуюся. Симптомы генерализованного пародонтита будут зависеть от степени выраженности воспаления.
Поэтому мы опишем только генерализованную форму, как наиболее часто встречающуюся. Симптомы генерализованного пародонтита будут зависеть от степени выраженности воспаления.
Пародонтит легкой степени.
Визуально определяется большое количество мягкого зубного налета, твердых зубных отложений, включая поддесневые зубные камни. Отмечается воспаление краевой десны, десневых сосочков: десна выглядит ярко красной или синюшной. Воспаленная десна легко кровоточит, например, при чистке зубов. Костная ткань вокруг зубов начинает рассасываться. Атрофия кости достигает 1/4-1/5 длины корня, что хорошо видно на рентгенографических снимках. Имеются пародонтальные (зубодесневые) карманы глубиной до 3,5 мм, из которых выделяется серозно- гнойный экссудат.
Пародонтит средней степени тяжести.
Происходит дальнейшее нарастание симптомов. Количество пародонтальных карманов увеличивается, а их глубина достигает 5 мм. Выделение серозно- гнойного экссудата из них становится более выраженным.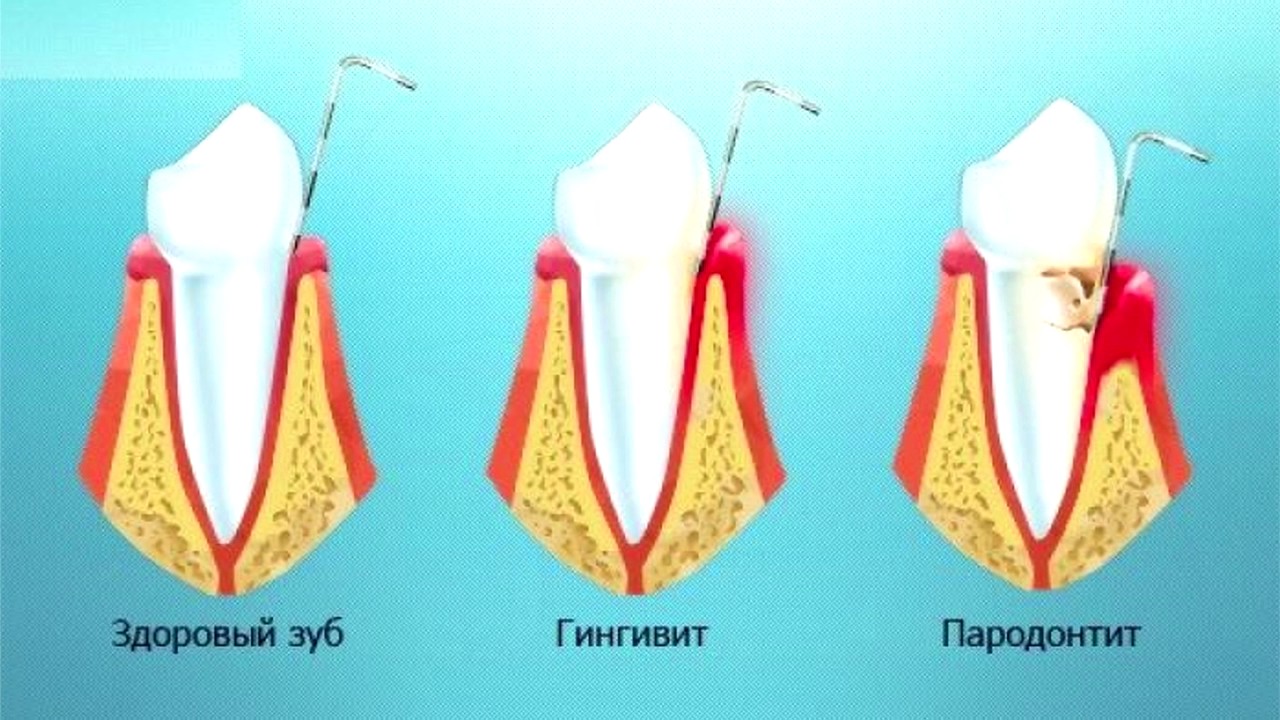 Атрофия костной ткани вокруг зубов достигает 1/3-1/2 длины корней. Атрофия кости приводит к появлению подвижности зубов (1-2 степени, т.е. умеренная подвижность). Часто происходит обнажение шеек зубов и корней, или возможно наоборот воспалительное разрастание десны по типу гипертрофического гингивита. При обострении хронического воспаления могут возникать пародонтальные абсцессы (гнойники в деснах).
Атрофия костной ткани вокруг зубов достигает 1/3-1/2 длины корней. Атрофия кости приводит к появлению подвижности зубов (1-2 степени, т.е. умеренная подвижность). Часто происходит обнажение шеек зубов и корней, или возможно наоборот воспалительное разрастание десны по типу гипертрофического гингивита. При обострении хронического воспаления могут возникать пародонтальные абсцессы (гнойники в деснах).
Часто на этом этапе возникают вторичные деформации зубных рядов – зубы начинают «разъезжаться», т.к. ослабленные ткани, удерживающие зубы в кости, не выдерживают жевательного давления. Особенно это заметно в области передних зубов. Ухудшается общее состояние больных: появляется повышенная утомляемость, слабость, также происходит снижение иммунитета и частые простудные заболевания.
Пародонтит тяжелой степени.
Происходит дальнейшее нарастание симптомов. Тяжелый пародонтит характеризуется часто возникающими обострениями, которые сопровождаются образованием абсцессов, резким припуханием десен, болями в них, увеличением подвижности зубов.
При тяжелой форме больные начинают страдать не только от местных симптомов, но также жалуются на слабость, недомогание, плохой сон, аппетит, обострение хронических заболеваний внутренних органов и т.д. Особенно сильно ухудшается состояние больных сахарным диабетом, сердечно-сосудистыми, гормональными, ревматоидными заболеваниями.
Обострение хронического пародонтита.
Существует также такое понятие, как «Течение заболевания». Для пародонтита характерно хроническое течение, когда симптоматика сглажена (без острых явлений воспаления), при этом периодически может возникать обострение пародонтита. Во время обострений симптоматика становится Острой, т.е. симптомы обостряются, становятся резко выраженными. Развитие обострения может быть связано как с истощением местных защитных механизмов полости рта, так и со снижением иммунитета организма.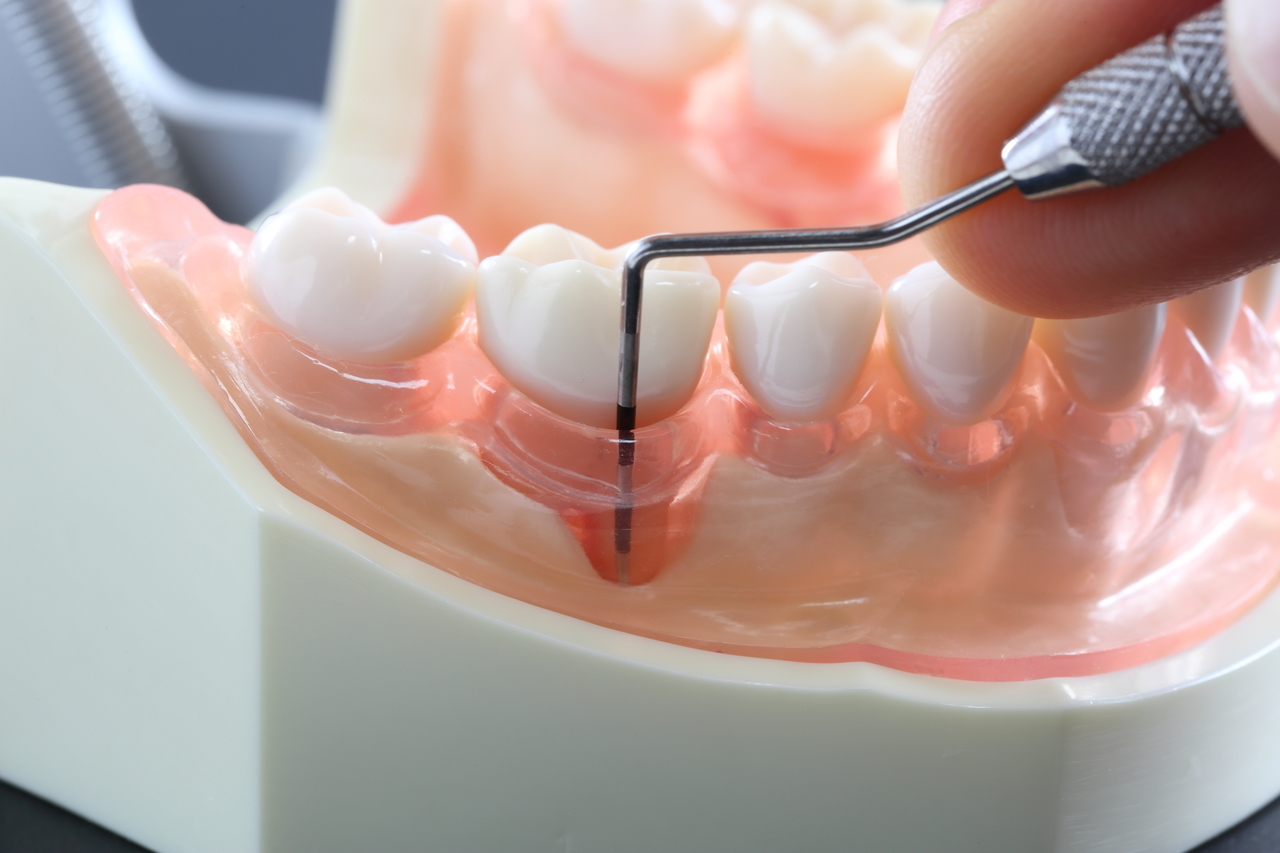
Диагностика пародонтита должна учитывать не только симптоматику и жалобы пациентов, но и обязательное рентгенографическое исследование. Как правило, при пародонтите проводят панорамную рентгенографию (ортопантомограмма). На таком панорамном снимке видны сразу все зубы и степень атрофии костной ткани у каждого зуба.
Пародонтит и Пародонтоз во время беременности.
Очень часто пациенты ошибочно используют термин «пародонтоз», подразумевая под ним заболевание, которое в действительности называется «пародонтит». Перед началом лечения нужно правильно поставить диагноз, т.к. вместо пародонтита у беременной женщины может оказаться гингивит беременных.
Какие же отличия пародонтоза и пародонтита у беременных?
Пародонтоз -это обменно-дистрофическое заболевание, которое проявляется медленной убылью десны и обнажением корней зубов. При этом воспаление в деснах отсутствует, при пародонтозе никогда не бывает ни кровоточивости, ни отека, ни болей.
Пародонтит — наоборот является воспалительным заболеванием десен, проявляющееся их кровоточивостью, отеком, покраснением или синюшностью, болями, образованием пародонтальных (зубодесневых) карманов с гнойным отделяемым. При средней и тяжелой степени пародонтита к описанным симптомам также присоединяется подвижность зубов, обнажение шеек и корней зубов.
Пародонтит является следующим этапом развития хронического гингивита, который не был вовремя вылечен. Причина гингивита и пародонтита одинакова. Это недостаточная гигиена полости рта, при которой на зубах скапливается большое количество мягкого микробного зубного налета и твердых над и поддесневых зубных отложений.
Во время беременности у женщин появляется изменение гормонального фона, который является предрасполагающим фактором, что и ускоряет переход гингивита в пародонтит.
Отличия гингивита и пародонтита у беременных.
1. Симптомы гингивита у беременных:
— на зубах мягкий микробный зубной налет (микробная бляшка) и твердые наддесневые зубные отложения,
— кровоточивость десны (особенно при чистке зубов, при приеме жесткой пищи)
— покраснение или синюшность десны,
— иногда боли в десне,
— у беременных женщин (из-за гормональных изменений) к этим симптомам может присоединиться разрастание десневого края.
Гингивит является начальной стадией воспаления десны, при которой отсутствует образование пародонтальных карманов, подвижность зубов, обнажение корней зубов.
2. Симптомы пародонтита во время беременности:
Все вышеперечисленные симптомы гингивита, при пародонтите сохраняются.Основным отличием пародонтита от гингивита является:
— разрушение костной ткани вокруг зубов (при легкой форме пародонтита атрофия кости достигает 1/3 длины корня, при средней степени тяжести – до 1/2 длины корня, при тяжелом пародонтите атрофия достигает 2/3 и более длины корня),
— образование пародонтальных (зубодесневых) карманов (при разрушении кости одновременно происходит образование пародонтальных карманов и разрушение зубо-десневого прикрепления). Глубина пародонтальных карманов зависит от тяжести воспаления и может составлять от 2-3 мм до 10 мм. Из пародонтальных карманов обычно выделяется серозно-гнойный экссудат,
— появление подвижности зубов,
— обнажение шеек и корней зубов,
— на рентгенограмме будет видно, что уровень костной ткани соответствует норме (при гингивите разрушения костной ткани на рентгене Вы никогда не увидите), а на рентгенограмме, сделанной у пациента с пародонтитом средней степени тяжести будет видно, что костная ткань разрушена на 1/2 длины корня.
Лечение пародонтита у беременных.
Напомним, что основная причина развития пародонтита – это твердые зубные отложения и мягкий микробный зубной налет. Поэтому лечение будет направлено на устранение этих причин.
Удаление над и поддесневых зубных отложений это самый главный этап лечения, т.к. если не удалить причину заболевания, то все остальные мероприятия дадут, лишь временный и весьма небольшой эффект.
Снимают зубные отложения чаще ультразвуком, но можно делать это ручными инструментами. После снятия отложений зубки обязательно полируются специальными щетками и пастами.
В первом триместре беременности обычно любые стоматологические вмешательства (анестезия, лечение зубов) противопоказаны, но зубные отложения снимать можно. Но, если возможно, то лучше даже такую процедуру перенести на второй триместр. Второй триместр является наиболее безопасным для лечебных процедур.
В третьем триместре снимать зубные отложения тоже можно, но в связи с повышенной утомляемостью и нервозностью беременных в этот период – лучше всё же (если есть такая возможность) перенести процедуры на период после родов.
После снятия зубных отложений, врач назначает противовоспалительную терапию индивидуально.
Противовоспалительная терапия – это такая терапия, которая обычно состоит из антисептических полосканий и аппликаций противовоспалительными гелями. Курс обычно длится 10 дней, проводить его можно (в случае невыраженного воспаления) даже в домашних условиях. Напоминаем, что эффективен такой курс будет только после снятия зубных отложений.
Врач назначит вам самые безопасные средства для антисептического полоскания полости рта. Лучше использовать готовые растительные эликсиры для полосканий, которые продаются в аптеках. Но правильный выбор средств сможет сделать только врач! Кроме полосканий врач назначит и аппликации на десну противовоспалительных гелей.
Многие гели не рекомендуется назначать беременным женщинам в 1-м триместре беременности (во 2-3- м триместрах – можно).
Правильно назначенные стоматологом гели наносятся на краевую часть десны и межзубные сосочки, как с передней, так и с задней поверхности зубов. После нанесения желательно 2-3 часа не принимать пищу и не полоскать рот (пить можно). Наносятся 2 раза в день утром и вечером сразу после полоскания антисептиками. Курс не более 10 дней.Так же врач подберет для Вас противовоспалительные зубные пасты –примером хорошей противовоспалительной зубной пасты является, например, «Пародонтакс». Эта паста содержит высокие концентрации лекарственных трав, а также содержит в своем составе небольшое количество солей (поэтому солоноватая на вкус). Содержание солей позволяет вытягивать из десен и зубодесневых карманов.
После нанесения желательно 2-3 часа не принимать пищу и не полоскать рот (пить можно). Наносятся 2 раза в день утром и вечером сразу после полоскания антисептиками. Курс не более 10 дней.Так же врач подберет для Вас противовоспалительные зубные пасты –примером хорошей противовоспалительной зубной пасты является, например, «Пародонтакс». Эта паста содержит высокие концентрации лекарственных трав, а также содержит в своем составе небольшое количество солей (поэтому солоноватая на вкус). Содержание солей позволяет вытягивать из десен и зубодесневых карманов.
После снятия зубных отложений и назначения противовоспалительной терапии, стоматолог на приеме обучит Вас адекватной гигиене полости рта, т.к. все воспалительные заболевания десен связаны с недостаточной гигиеной полости рта.
У беременных женщин (в связи с гормональной перестройкой) воспаление возникает даже при минимальном количестве зубного налета и зубного камня, в связи с чем, им нужно уделять гигиене в 2 раза больше времени, чем остальным людям.
Огромную помощь в поддержании гигиены полости рта может оказать ирригатор для промывания межзубных промежутков, пародонтальных карманов и других труднодоступных участков полости рта. Так же беременным нужно соблюдать правильный режим питания. Для этого необходимо избегать частых перекусываний и потребления сладких напитков между основными приемами пищи. Если Вы съели печенюшку или конфетку – значит нужно идти чистить зубы, т.к. углеводы – это главное сырье для размножения микробов в полости рта. Если Вам лень выполнять это простое правило, то это по большому счету говорит о бессмысленности лечения и неизбежном прогрессировании заболевания даже в случае проведения противовоспалительных мероприятий.
Дополнительные лечебные мероприятия при заболеваниях пародонта.
Если у Вас гингивит, то всего вышеперечисленного вполне достаточно, чтобы вылечить это заболевание и забыть о кровоточивости десен. Но если у Вас развился Пародонтит, то все вышеперечисленные мероприятия – это только базовое лечение, направленное на снятие симптомов воспаления. Как известно при пародонтите возникает подвижность зубов, появляются глубокие пародонтальные (зубодесневые) карманы, поэтому необходимы дополнительные лечебные мероприятия. К ним относится шинирование подвижных зубов, кюретаж пародонтальных карманов.
Как известно при пародонтите возникает подвижность зубов, появляются глубокие пародонтальные (зубодесневые) карманы, поэтому необходимы дополнительные лечебные мероприятия. К ним относится шинирование подвижных зубов, кюретаж пародонтальных карманов.
Статью подготовила: Заведующий отделением: врач-стоматолог-терапевт Логиновских Татьяна Сергеевна
Пародонтопатия
Определение.
Под термином «пародонтопатия» понимают воспалительные и дегенеративные процессы, затрагивающие пародонт (десны, альвеолы зубов, десмодонт, цемент корней).
Характеристики.
Пародонтопатия характеризуется прогрессирующей резорбцией костной ткани зубных альвеол, воспалением десен и расшатыванием зубов.
Этиология пародонтопатии обусловлена сочетанием многих факторов: генетической предрасположенностью, особенностями породы, возрастом и состоянием здоровья.
Функциональные нарушения печени или почек могут также способствовать развитию пародонтопатии.
Породы.
Возраст.
Маленькие собаки страдают значительно чаще, чем крупные, это обычно животные старше 8 лет.
У крупных собак, наоборот, болезнь развивается в первые 2 года жизни преимущественно из-за переломов зубов.
Патогенез.
Вначале откладывается на зубах налет из мукоидов слюны и микроорганизмов. В него осаждаются кальций, фосфаты
В результате такой минерализации на зубах формируется камень. Он состоит из гидроксилапатита.
Образующийся зубной камень характеризуется по локализации.
Супрагингивальный камень желтовато-коричневого цвета прикрепляется на свободной поверхности зуба.
Субгингивальный камень локализуется в карманах десен. Он темно-зеленого цвета и тверже первого. Было установлено, что отложение субгингивального камня связано с биохимическими отклонениями в сыворотке крови, а супрагингивального зависит от состава слюны, в частности от снижения содержания в слюне муцина.
Класификация.
Выделяют три формы пародонтопатии: краевую, апикальную и гиперпластическую.
КРАЕВАЯ ПАРОДОНТОПАТИЯ.
Она наиболее распространена (77%).
Породность.
Собаки мелких пород страдают в 5 раз чаще.
Патогенез.
Отложившийся на зубах камень оттесняет край десны от зубной эмали, образуются десневые карманы.
В карманах накапливаются остатки пищи, спущенные клетки эпителия, микробы. Под воздействием последних скопившийся в карманах субстрат превращается в гной. Возникает пародонтит.
Стрептококки, являющиеся основными представителями микрофлоры, вырабатывают гиалуронидазу, разрушающую тканевый цемент — гиалуроновую кислоту. Происходит разрыхление ткани десен.
При активно текущем фагоцитозе образуются ферменты, которые способствуют дальнейшей деструкции десен и зубных альвеол, ведущей к расшатыванию зубов.
При этом формируются костные карманы, их можно обнаружить рентгенологически. Появление костных карманов следует расценивать как признак прогрессирующей пародонтопатии.
АПИКАЛЬНАЯ ПАРОДОНТОПАТИЯ.
Встречается реже — только у 17% собак с пародонтопатией.
Локализация.
Обычно поражается четвертый верхнечелюстной премоляр. Он несет нагрузку размельчения костей. При этом может возникнуть перелом зуба с обнажением и последующим инфицированием пульпы, развитием посттравматического пародонтита. В других случаях инфекция заносится гематогенным путем.
Особенности.
Процесс носит локальный характер, начинается в области верхушек корней зубов.
В острых случаях может возникнуть абсцесс, абсцедирование на поверхности кожи щеки, в преддверии рта или в полости носа.
При хроническом течении болезни в процесс вовлекается костная ткань челюсти, образуется очаговый остеолиз в периапикальной части корня зуба.
Рентген.
На рентгенограмме зона остеолиза хорошо различима. Полость со временем замещается грануляционной тканью с формированием гранулемы или заполняется кистозной жидкостью. Киста всегда имеет тенденцию к росту.
Рентгенологически ее трудно отличить от периапикальной гранулемы, разве что она имеет большие размеры, четкие границы и равномерную зону просветления.
ГИПЕРПЛАСТИЧЕСКАЯ ПАРОДОНТОПАТИЯ.
К этой форме относят эпулисы.
Особенности.
Это медленно растущие, твердые, похожие на цветную капусту очаговые разрастания десны.
Этиология.
Предполагается пародонтальное происхождение эпулисов.
Локализация.
Они часто локализуются на верхней челюсти — в области клыка или первого премоляра.
ЛЕЧЕНИЕ, РАЗВИТИЕ И ПРОГНОЗ
КРАЕВАЯ ПАРОДОНТОПАТИЯ.
АПИКАЛЬНАЯ ПАРОДОНТОПАТИЯ.
ГИПЕРПЛАСТИЧЕСКАЯ ПАРОДОНТОПАТИЯ.
Лечение.
При пародонтопатиях лечение направлено на приостановление дальнейших потерь пародонтальной ткани, укрепление коллагеновых волокон-связок на корнях зубов, устранение карманов.
В первую очередь проводят санацию полости рта и удаляют зубной камень.
Собак старше 6 лет с тенденцией к камнеобразованию следует подвергать этой процедуре каждые 6 мес. Под общей анестезией стоматологическим экскаватором снимают супра- и субгингивальный камень, выскабливают карманы в деснах.
После удаления камня зубы очищают 3 %-ным раствором перекиси водорода и дополнительно в течение 3-5 дней назначают антибиотики тетрациклинового ряда.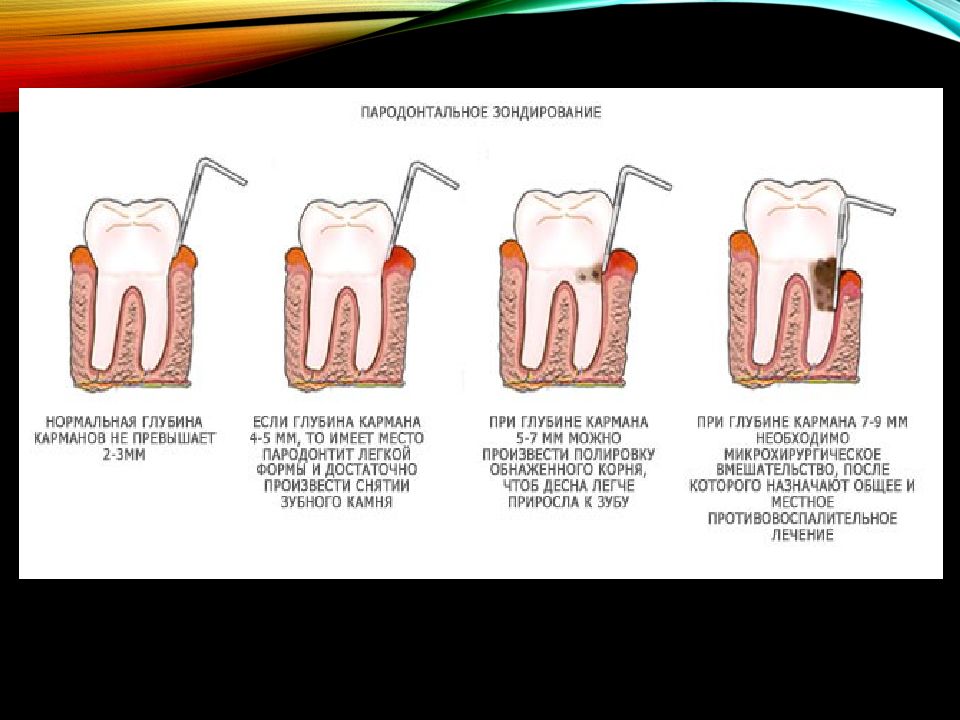
Патологические разрастания десны или обширные карманы иссекают электроножом (это уменьшает кровотечение), косо срезая ткань десны снизу вверх по границе зубной альвеолы.
Зубы, пришедшие в негодность, удаляют стоматологическими щипцами.
Заболевания пародонта | BIOCODEX BMI PRO
Заболевания пародонта – это распространенные и необратимые заболевания, которые в конце концов могут привести к потере зубов. Их возникновение связано с дисбалансом микрофлоры в зубном налете.
Тяжелые заболевания пародонта встречаются у 15–20% людей среднего возраста (в возрасте 35–44 года)1. Наряду с кариесом они являются основной причиной потери зубов. Согласно ВОЗ, почти у 30 % людей в возрасте 65–74 года не осталось естественных зубов1.
Необратимое заболевание
Заболевания пародонта – это инфекционные заболевания тканей опорного аппарата зуба (десен, корня, альвеолярных костей). Они приводят к воспалению, кровоточивости десен и необратимому образованию зубодесневых карманов.
Предрасполагающие факторы, включая дисбаланс микробиоты полости рта
Развитию заболеваний пародонта способствует много факторов: возраст, курение, алкоголь, сахарный диабет, ВИЧ, определенные медикаменты, менопауза, беременность и особенно плохая гигиена полости рта2. Наличие глубоких пародонтальных карманов и потеря пародонтального прикрепления связаны с наличием зубного налета и зубного камня. Заболевание также связано с развитием внутри этого налета патологической бактериальной микрофлоры3, 4, включая патогенные анаэробные штаммы, такие как Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia и Fusobacterium nucleatum2, 3.
Удалить зубной налет
Лечение первой линии состоит в остановке прогрессирования заболевания пародонта: удаление наддесневого зубного камня и зубных отложений в сочетании с лечением антисептиками и антибиотиками2. Иногда может потребоваться хирургическое лечение. Во всех случаях основным направлением является обучение гигиене полости рта2.
Во всех случаях основным направлением является обучение гигиене полости рта2.
Потенциальное применение пробиотиков
Нарушение баланса микрофлоры полости рта, приводящее к болезням пародонта, может оправдать применение пробиотиков с лечебно-профилактической целью. Например, пациентам с большим количеством P. gingivalis может быть полезно использование пробиотиков до появления заболевания пародонта3. В нескольких клинических исследованиях была показана эффективность таких пробиотиков, как L. reuteri и L. salivarius в лечении кровоточивости десен и профилактике формирования пародонтальных карманов4–8.
Источники:
1- OMS Santé bucco-dentaire. http://www.who.int/mediacentre/factsheets/fs318/fr/
2- Haute Autorité de santé. Parodontopathies : diagnostic et traitements, mai 2002. https://www.has-sante.fr/portail/upload/docs/application/pdf/Parodontopathies_rap.
3- Zarco MF et al. The oral microbiome in health and disease and the potential impact on personalized dental medicine. Oral Diseases (2012) 18, 109–120
4- Martin-Cabezas R et al. Clinical efficacy of probiotics as an adjunctive therapy to non-surgical periodontal treatment of chronic periodontitis: a systematic review and meta-analysis. J Clin Periodontol. 2016;43:520-30. https://www.ncbi.nlm.nih.gov/pubmed/26970230
5- Iwamoto T et al.. Effects of probioticLactobacillus salivarius WB21 on halitosis and oral health: an open-label pilot trial. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010 ;110:201-8. https://www.ncbi.nlm.nih.gov/pubmed/20659698
6- İnce G et al.. Clinical and Biochemical Evaluation of Lozenges Containing Lactobacillus reuteri as an Adjunct to Non-Surgical Periodontal Therapy in Chronic Periodontitis. J Periodontol. 2015 ;86:746-54 https://www.ncbi.nlm.nih.gov/pubmed/25741580
7- Cocco F, Lingström P, Campus G.The use of probiotic strains in caries prevention: a systematic review. Nutrients. 2013 ;5:2530-50. https://www.ncbi.nlm.nih.gov/pubmed/23857225
8- Twetman S, Keller MK. Probiotics for caries prevention and control. Adv Dent Res. 2012 ;24:98-102. https://www.ncbi.nlm.nih.gov/pubmed/22899689
Что такое пародонтит легкой, средней и тяжелой степени
Специалисты считают, что эффективное лечение пародонтита может гарантировать своевременная диагностика. Естественно, она должна быть корректной — только тогда врач сможет точно определить степень тяжести заболевания, а значит, и назначить правильное лечение
Классификация такой болезни, как пародонтит, учитывает места его локализации, стадии развития и степени тяжести заболевания. В зависимости от степени тяжести различают пародонтит легкой, средней и тяжелой формы.
Степень тяжести пародонтита определяется по трем основным признакам:
- глубина пародонтального кармана
- степень резорбции (разрушения, рассасывания) костной ткани
- патологическая подвижность зубов.
 Она может иметь четыре степени: зуб отклоняется в разных направлениях не более чем на 1 мм; зуб отклоняется больше чем на 1 мм; зуб шатается во всех направлениях, в том числе и вертикальном, при отсутствии соседних зубов может быть наклонен; и зуб можно повернуть вокруг своей оси.
Она может иметь четыре степени: зуб отклоняется в разных направлениях не более чем на 1 мм; зуб отклоняется больше чем на 1 мм; зуб шатается во всех направлениях, в том числе и вертикальном, при отсутствии соседних зубов может быть наклонен; и зуб можно повернуть вокруг своей оси.
Легкая степень
- Симптомы: пульсация в деснах, неприятный запах изо рта, зуд, кровоточивость и неприятные ощущения во время приема твердой пищи
- Характеристика: для пародонтита легкой степени характерно отсутствие подвижности зубов, при этом высота межзубных перегородок уменьшается на 1/3, а глубина пародонтальных карманов может достигать 3,5 мм
- Лечение: профессиональная санация полости рта, удаление зубного камня, противовоспалительное лечение, физиотерапевтические процедуры
Средняя степень
- Симптомы: опорный аппарат зуба начинает расшатываться, увеличивается чувствительность и подвижность зубов, десны часто кровоточат, отекают и воспаляются, из пародонтальных карманов могут появляться гнойные выделения
- Характеристика: пародонтит средней степени тяжести вызывает патологическую подвижность зубов 1 и 2 степени, из-за чего происходит смещение зубов, образующих промежутки в зубном ряду.
 Высота межзубных перегородок уменьшается до 1/2 их длины, а глубина пародонтального кармана доходит до 5 мм
Высота межзубных перегородок уменьшается до 1/2 их длины, а глубина пародонтального кармана доходит до 5 мм - Лечение: удаление мягкого и твердого налета, глубокая чистка зубов, прием антибиотиков, аппликации на дёсны антимикробных и противовоспалительных препаратов, физиотерапевтическое лечение
Тяжелая степень
- Симптомы: острая зубная боль, общее недомогание, повышенная температура тела, гнойные выделения при надавливании на десну, сильное смещение и быстрое выпадение зубов.
- Характеристика: пародонтит тяжелой степени характеризуется наличием 3 и 4 степени патологической подвижности зубов, в результате чего может произойти их полная потеря. Глубина пародонтального кармана свыше 6–7 мм. Высота межзубных перегородок снижается более чем на 1/2 их длины.
- Лечение: санация полости рта, удаление зубов при глубине пародонтального кармана более 8 мм, хирургическое лечение
Мнение эксперта
Все степени пародонтита имеют свои особенности течения болезни и могут привести к осложнениям, а иногда и к необратимым последствиям, поэтому очень важно своевременно обратиться к специалисту. Врач выявит причины заболевания и назначит соответствующее лечение. В рамках комплекса лечебных мероприятий обычно проводится обработка пародонтальных карманов, очистка их от скоплений микробов и отмерших тканей, а также удаление зубных камней, способствующих появлению воспалительных заболеваний полости рта.
Врач выявит причины заболевания и назначит соответствующее лечение. В рамках комплекса лечебных мероприятий обычно проводится обработка пародонтальных карманов, очистка их от скоплений микробов и отмерших тканей, а также удаление зубных камней, способствующих появлению воспалительных заболеваний полости рта.
При тяжелой степени пародонтита нередко требуется хирургическое вмешательство. Естественно, чем раньше вы обратитесь за помощью с этой проблемой, тем более простым, быстрым, безболезненным и дешевым окажется ее решение. К сожалению, многие пациенты все еще не могут до конца осознать этот очень простой факт.
Пародонтопатии
Пародонтопатии (синоним: парадентопатии, периодонтопатии) — это заболевания тканей опорного аппарата зуба. Пародонтопатии — собирательное понятие, включающее любое заболевание пародонта независимо от этиологии, клиники и локализации процесса. На этом основании к пародонтопатиям причисляют не только воспалительные и дистрофические заболевания пародонта (см. ), но и опухолевые, например эпулис, фиброматоз десен, а также эозинофильную гранулему челюстей. Раздел стоматологии, изучающий пародонтопатии, получил название «пародонтология».
), но и опухолевые, например эпулис, фиброматоз десен, а также эозинофильную гранулему челюстей. Раздел стоматологии, изучающий пародонтопатии, получил название «пародонтология».
Заболевания пародонта исключительно разнообразны как по клинико-морфологической картине, так и по этиологии и патогенезу. В связи с этим классификация пародонтопатий представляет значительные трудности. ARPA (международное общество по изучению пародонтоза) предложило следующую классификацию пародонтопатий: 1) воспалительная пародонтопатия — пародонтит поверхностный (гингивит) и глубокий; 2) дистрофическая пародонтопатия — пародонтоз; 3) неопластическая пародонтопатия — пародонтома. Последние встречаются сравнительно редко и по существу представляют самостоятельную группу, не имеющую патогенетической связи с остальными заболеваниями пародонта. Термином «пародонтоз» обозначают лишь невоспалительные поражения пародонтальных тканей. Воспалительные же заболевания всего комплекса тканей пародонта, сопровождающиеся гноетечением и рассасыванием стенок альвеолы, обозначают термином «пародонтит глубокий». Из всех форм пародонтопатий наиболее часто встречаются гингивиты. Взрослые люди, у которых сохранились естественные зубы, в 75% случаев страдают гингивитом (поверхностным пародонтитом) или глубоким пародонтитом, при котором гингивит является обязательным симптомом.
Из всех форм пародонтопатий наиболее часто встречаются гингивиты. Взрослые люди, у которых сохранились естественные зубы, в 75% случаев страдают гингивитом (поверхностным пародонтитом) или глубоким пародонтитом, при котором гингивит является обязательным симптомом.
Пародонтопатия — полиэтиологическое заболевание. В некоторых случаях ведущей причиной возникновения воспалительной пародонтопатии являются местные раздражители — зубной камень, белый налет на зубах, неудовлетворительные пломбы и протезы, инфекция и пр. В развитии гингивитов имеют значение также профессиональные факторы — мучная, табачная, суперфосфатная, металлическая пыль и др. Особое значение в этиологии пародонтопатии имеют нарушения окклюзии и артикуляции, превышающие пределы компенсаторных возможностей пародонта и ведущие к его перегрузке. Такую же роль играет бруксизм (ночное скрежетание зубами). Как известно, пародонт представляет весьма чувствительную рефлексогенную зону, кроме того, капилляры десны ввиду анатомических особенностей (они длинны, извиты) весьма чувствительны к любым эндо- и экзотоксинам. В связи с этими особенностями строения пародонта пародонтопатии могут возникнуть на почве заболевания различных органов и систем — желудочно-кишечного тракта, нервной системы, гормональных нарушений, сосудистых нарушений, при гиповитаминозах, болезнях крови, диабете, при отравлениях тяжелыми металлами (ртутью, свинцом, висмутом и др.), при аллергиях.
В связи с этими особенностями строения пародонта пародонтопатии могут возникнуть на почве заболевания различных органов и систем — желудочно-кишечного тракта, нервной системы, гормональных нарушений, сосудистых нарушений, при гиповитаминозах, болезнях крови, диабете, при отравлениях тяжелыми металлами (ртутью, свинцом, висмутом и др.), при аллергиях.
Клинические проявления пародонтопатий весьма разнообразны. Разнообразны также и морфологические изменения. Интенсивность проявления любой пародонтопатии, течение заболевания во многом зависят не только от силы раздражителя, но и от индивидуальных особенностей пародонта и главным образом от реактивности организма. Те или иные этиологические факторы, влекущие за собой трофические нарушения в пародонте, действуя отдельно или в совокупности, в одних случаях при определенной реактивности организма могут вызвать одну форму пародонтопатии, в других случаях — другую.
Пародонтопатия. Стоматология собак
Пародонтопатия
Под термином «пародонтопатия» понимают воспалительные, дистрофические и дегенеративные процессы, затрагивающие пародонт (десны, альвеолы зубов, периодонт, цемент корней). Пародонтопатия характеризуется прогрессирующей резорбцией костной ткани зубных альвеол, воспалением десен и расшатыванием зубов.
Пародонтопатия характеризуется прогрессирующей резорбцией костной ткани зубных альвеол, воспалением десен и расшатыванием зубов.
Этиология. Причины возникновения пародонтопатии различны: генетическая предрасположенность, особенность экстерьера и породы, возраст и состояние породы.
Большую роль в развитии пародонтопатии играет отложение зубного камня. Установлено, что в 98% случаях пародонтопатии наблюдалось отложение зубного камня.
Маленькие декоротивные породы собак страдают этим заболеванием значительно чаще, чем крупные породы, особенно после 7–8-летнего возраста.
У крупных собак пародонтопатия регистрируется раньше – с 2–3 лет. Раннее появление пародонтопатии у крупных животных было связано в первую очередь с повреждениями и переломами зубов.
Функциональные нарушения печени или почек могут способствовать развитию пародонтопатии.
Развитие болезни. Вначале на зубах откладывается налет из мукоидов слюны и микроорганизмов. В него осаждаются в основном кальций и фосфор. В результате такой минерализации совместно с частичками корма на зубах формируется зубной камень. Разрастаясь на поверхности зубов, он проникает под десну, отодвигая ее от зуба и формируя большие десневые карманы. При прогрессирующем проникновении зубного камня под десну происходит оголение корней зубов и появление костной ткани челюсти.
В него осаждаются в основном кальций и фосфор. В результате такой минерализации совместно с частичками корма на зубах формируется зубной камень. Разрастаясь на поверхности зубов, он проникает под десну, отодвигая ее от зуба и формируя большие десневые карманы. При прогрессирующем проникновении зубного камня под десну происходит оголение корней зубов и появление костной ткани челюсти.
Проникновение в толщу пародонта микроорганизмов, их токсинов, частиц корма, продуктов воспаления и распада тканей приводит к нарушению нервной регуляции и питания околозубных тканей.
Нарушение нервной регуляции и накопление продуктов распада тканей приводят к изменению клеточного строения зубочелюстной системы. В первую очередь происходит атрофия костной лунки – основной опоры зуба. В результате устойчивость зуба ослабевает. Одновременно у собак уменьшается выносливость зуба к силовой нагрузке. Вследствие недостаточной устойчивости самого зуба в альвеоле и дополнительной нагрузки во время приема корма происходит непрерывная травма опорных тканей, что способствует, в свою очередь, атрофии кости.
Формы пародонтопатии. Выделяют три формы пародонтопатии: краевую, апикальную и гиперпластическую.
1. Краевая пародонтопатия. Одна из самых распространенных форм, которая составляет порядка 77%. Собаки мелких пород страдают ею в 5 раз чаще. Краевая пародонтопатия возникает за счет разрыхления тканей десен. При активно текущем фагоцитозе образуются ферменты, которые способствуют дальнейшей деструкции десен и зубных альвеол, ведущие к более сильному расшатыванию зубов. При этом формируются костные карманы. Их наличие можно обнаружить на рентгеновском снимке. Появление костных карманов следует расценивать как признак прогрессирующей пародонтопатии.
2. Апикальная пародонтопатия. По сравнению с первой формой встречается значительно реже – около 17–20% случаев.
Обычно поражается четвертый верхнечелюстной премоляр. Он несет нагрузку размельчения костей. При этом может возникнуть перелом зуба с обнажением, последующим инфицированием пульпы и развитием воспаления не только самого зуба, но и окружающих его тканей. В других случаях возникновение данной формы пародонтопатии происходит за счет заноса инфекции кровяным руслом.
В других случаях возникновение данной формы пародонтопатии происходит за счет заноса инфекции кровяным руслом.
Процесс носит локальный характер, начинается в области верхушек корней зубов. В острых случаях может возникнуть абсцесс. Как правило, абсцедирование происходит на поверхности кожи щеки, в преддверии ротовой полости или полости носа.
При хроническом течении болезни в процесс вовлекается костная ткань челюсти, что приводит к образованию очагового остеолиза в периапикальной части корня зуба.
На рентгенограмме зона остеолиза хорошо различима. Полость остеолиза со временем замещается грануляционной тканью с формированием гранулемы.
Иногда полость заполняется кистозной жидкостью, и образуется киста. Киста всегда имеет тенденцию к росту. Рентгенологически ее трудно отличить от периапикальной гранулемы, разве что она имеет большие размеры, четкие границы, и равномерную зону просветления.
3. Гиперпластическая пародонтопатия. Редкая форма, которая встречается в 3–4% случаев.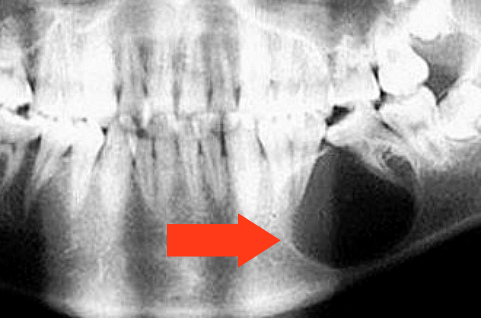 Представляет собой медленно растущие, твердые, похожие на цветную капусту очаговые разрастания десны. Гиперпластическая пародонтопатия часто локализуется на верхней челюсти – в области клыка или первого премоляра.
Представляет собой медленно растущие, твердые, похожие на цветную капусту очаговые разрастания десны. Гиперпластическая пародонтопатия часто локализуется на верхней челюсти – в области клыка или первого премоляра.
К гиперпластической форме пародонтопатии относят различные виды эпулидов (доброкачественные новообразования, встречаемые только в полости рта).
Лечение. При пародонтопатиях лечение направлено в первую очередь на приостановление дальнейших потерь пародонтальной ткани, укрепление коллагеновых волокон-связок на корнях зубов, устранение десневых карманов. Вначале проводят санацию ротовой полости и удаляют зубной камень. Удаление зубного камня производят с помощью стоматологических экскаваторов. Очень тщательно выскабливают камень из десневых карманов.
После полного удаления камня зубы очищают 3%-ным раствором перекиси водорода. Десны обрабатывают антисептическими растворами. Очень хороший результат дает обработка десны 1%-ным водным раствором метиленовой сини. Дополнительно назначают антибиотики широкого спектра антибактериального действия.
Дополнительно назначают антибиотики широкого спектра антибактериального действия.
Патологические разрастания десны или обширные карманы иссекают. С целью уменьшения кровотечения иссекание желательно проводить электроножом. Разрез ткани десны проводят снизу вверх по границе зубной альвеолы.
Пришедшие в полную непригодность зубы удаляют с помощью стоматологических щипцов. Нежелательно удалять больные зубы, которые можно лечить, так как удаление большого количества зубов приводит к увеличению нагрузки на оставшиеся зубы. Это, в свою очередь, приводит к большому риску травмы имеющихся зубов и мягких тканей. В лечении заболевания костей челюсти хороший результат дает применение препарата под названием гелакан. Кроме того, в лечении пародонтопатии применяют иммуностимуляторы, витамины и минеральные вещества.
Профилактика. Профилактические меры сводятся в основном к поддержанию здорового состояния ротовой полости. Проводить санацию ротовой полости у собак не реже двух раз в год, а у мелких пород – не реже трех раз! При возникновении зубного налета и камня необходимо срочно их снимать.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесРазработка методики скрининга поражений пародонта у собак — Зооинформ
Hanne E Kortegaard1, Thomas Eriksen1 and Vibeke Baelum2
1 Department of Veterinary Clinical and Animal Sciences, Faculty of Health and Medical Sciences, University of Copenhagen, Denmark
2 Department of Dentistry, Aarhus University, Denmark
От редакции
Термин «periodontium» в англоязычных и некоторых других странах принят для обозначения тканей, которые в отечественной стоматологии обозначают как «пародонт». Соответственно, многими «periodontal disease» сходу переводится как «пародонтоз», что не совсем верно: пародонтоз — дистрофическая пародонтопатия — явление гораздо более редкое, чем пародонтопатии воспалительного или смешанного характера. Наши стоматологи предпочитают не использовать термин «пародонтоз» применительно к собакам, так как «чистая» дистрофическая пародонтопатия у них пока не описана. А зарубежные ветеринарные стоматологи, давая определение «periodontal disease», часто подчёркивают, что это весьма распространённое воспалительное заболевание. Автор же данной статьи не дифференцирует различные типы поражений пародонта, полностью сконцентрировавшись именно на проблеме их скрининга. Поэтому нам представляется правильным перевести данное словосочетание общим термином «пародонтопатия».
Наши стоматологи предпочитают не использовать термин «пародонтоз» применительно к собакам, так как «чистая» дистрофическая пародонтопатия у них пока не описана. А зарубежные ветеринарные стоматологи, давая определение «periodontal disease», часто подчёркивают, что это весьма распространённое воспалительное заболевание. Автор же данной статьи не дифференцирует различные типы поражений пародонта, полностью сконцентрировавшись именно на проблеме их скрининга. Поэтому нам представляется правильным перевести данное словосочетание общим термином «пародонтопатия».
Обнаружение у собак пародонтопатий на ранних стадиях важно для поддержания здоровья ротовой полости и предупреждения разрушения пародонта и связанного с этим риска системных осложнений [1–5]. Основная причина для анестезии у собак перед осмотром — плохая гигиена полости рта и галитоз, в случае чего лечение обычно сводится к тщательной чистке зубов и удалении разрушенных зубов, но иногда приходится прибегать и к более продвинутым методам, включая субгингивальный кюретаж и хирургическое восстановление альвеол челюсти. Бигли, живущие в вивариях, нуждаются в таком же уходе за полостью рта, как и домашние собаки. Последние исследования в человеческой медицине выявили, что поражения пародонта часто бывают связаны с системными заболеваниями, в особенности — с болезнями сердечно-сосудистой системы [6–8]. Обнаружена корреляция между пародонтопатиями и повышенным уровнем С-реактивного белка, связанного с развитием атеросклероза [9]. Пародонтопатия может вызывать осложнения системного характера, включая периопатогенную бактеремию и фокальные инфекции, поскольку в результате местного воспаления периодонта может привести к системной воспалительной и иммунной реакции [7]. Оценка периодонтального статуса у собак в клинических или экспериментальных целях сводится к оценке зубного налёта, степени воспаления и прочности связочного аппарата зуба. Сюда входит общий осмотр полости рта и оценка конкретных участков, оценка зубного налёта, воспалительного статуса дёсен, а также индекс ослабления крепления зуба (clinical attachment loss — CAL) и проба глубины зондирования карманов (probing pocket depth — PPD), подтверждённые рентгенографическими снимками альвеолярных структур всех 42-х зубов [10–14].
Бигли, живущие в вивариях, нуждаются в таком же уходе за полостью рта, как и домашние собаки. Последние исследования в человеческой медицине выявили, что поражения пародонта часто бывают связаны с системными заболеваниями, в особенности — с болезнями сердечно-сосудистой системы [6–8]. Обнаружена корреляция между пародонтопатиями и повышенным уровнем С-реактивного белка, связанного с развитием атеросклероза [9]. Пародонтопатия может вызывать осложнения системного характера, включая периопатогенную бактеремию и фокальные инфекции, поскольку в результате местного воспаления периодонта может привести к системной воспалительной и иммунной реакции [7]. Оценка периодонтального статуса у собак в клинических или экспериментальных целях сводится к оценке зубного налёта, степени воспаления и прочности связочного аппарата зуба. Сюда входит общий осмотр полости рта и оценка конкретных участков, оценка зубного налёта, воспалительного статуса дёсен, а также индекс ослабления крепления зуба (clinical attachment loss — CAL) и проба глубины зондирования карманов (probing pocket depth — PPD), подтверждённые рентгенографическими снимками альвеолярных структур всех 42-х зубов [10–14]. В связи с этим проведение полного осмотра полости рта занимает много времени даже у постоянно практикующих ветеринаров, из-за чего происходит нежелательное увеличение продолжительности анестезии.
В связи с этим проведение полного осмотра полости рта занимает много времени даже у постоянно практикующих ветеринаров, из-за чего происходит нежелательное увеличение продолжительности анестезии.
В предыдущем исследовании на гончих собаках [15] мы выяснили, что такие показатели, как CAL ≥ 1мм и PPD ≥ 4 мм относительно часто встречаются даже у молодых собак, но также верно и то, что эти признаки пародонтопатии обычно обнаруживаются не более чем на двух–трёх зубах. Так что от серьёзных последствий пародонтопатии страдает лишь малая часть собак. Такая эпидемиологическая картина говорит о том, что скрининг на пародонтопатию может проводиться у больших групп собак, позволяя быстро оценить состояние зубов и план лечения или для отбора собак с/без признаков пародонтопатий для клинических исследований.
Индекс ослабления крепления зуба (CAL) — основной параметр для оценки степени и распространённости пародонтопатий, оценка глубины зондирования карманов (PPD) в основном служит для определения объёма и тактики лечения, что делает эти два параметра наиболее подходящими для протокола скрининга, позволяя одновременно определить стадию процесса и метод лечения.
Многие исследования уже показали, что пародонтопатия у собак [15–18], так же, как и у людей [19–21], коррелирует с процессом роста зубов. Эта особенность используется для разработки метода скрининга собак на пародонтопатию. При этом учитывают общий индекс поражения пародонта для оценки степени заболевания с учётом роста зубов, в то время как мы в нашем исследовании собираемся оценивать распространённость пародонтопатий в рамках всей популяции [22; 23].
Основная цель нашего исследования — создать удобный, быстрый и точный инструмент для скрининга, высокоэффективного для выявления пародонтопатий.
Методы
Здесь будут использованы данные, полученные из предыдущего исследования [15], в котором 98 клинически здоровых собак породы бигль (57 сук и 41 кобель) в возрасте от 13 месяцев до 7 лет (средний возраст — 32,4 месяца, стандартное отклонение — 15,7 месяцев) и средним весом в 15 кг (среднее отклонение 2,2 кг) были осмотрены в ходе программы мониторинга заболеваемости. Все собаки были выращены в двух вивариях, разводящих биглей. В основном их кормили покупным сухим кормом и водой ad libitum. Этим собакам не проводили никакой профилактики заболеваний полости рта, они не осматривались по этому поводу в течение последнего года и состояние их ротовой полости было неизвестно перед осмотром. Протокол этого исследования был изучен и подтверждён Комитетом по уходу и содержанию животных при Учебном ветеринарном госпитале и Национальным ветеринарным советом по этике.
Все собаки были выращены в двух вивариях, разводящих биглей. В основном их кормили покупным сухим кормом и водой ad libitum. Этим собакам не проводили никакой профилактики заболеваний полости рта, они не осматривались по этому поводу в течение последнего года и состояние их ротовой полости было неизвестно перед осмотром. Протокол этого исследования был изучен и подтверждён Комитетом по уходу и содержанию животных при Учебном ветеринарном госпитале и Национальным ветеринарным советом по этике.
Рисунок 1. Общий вид дентиции у собак. Отмечены характерные осматриваемые места |
Процедура клинического осмотра
Всем собакам была проведена премедикация пропионил-промазином (0,05 мг/кг) и атропином (0,03 мг/кг) внутримышечно (в/м) или диазепамом (0,4 мг/кг) и атропином
(0,03 мг/кг) в/м. Для анестезии был использован пропофол — индукция с 4 мг/кг, в/в, затем поддерживающая доза
Для анестезии был использован пропофол — индукция с 4 мг/кг, в/в, затем поддерживающая доза
0,35 мг/кг/мин через инфузомат. Всем собакам был проведён полный осмотр всей ротовой полости. CAL измерялся в мм от цементоэмалевой границы до дна кармана, в 3–6 точках на каждом зубе в зависимости от типа зуба (рисунок 1). PPD измерялась в мм от края десны до дна кармана в тех же точках. Налёт удалялся только в том случае, если он мешал проведению зондирования. Всех собак осматривал один ветеринар. У одной из 25 собак, выбираемой случайно, проводился контрольный осмотр пяти случайно выбранных зубов в целях проверки осматривающего ветеринара [15].
Анализ результатов
Для каждого зуба выбиралось одно самое большое значение CAL и PPD вне зависимости от того, в какой точке оно было получено. Все зубы были распределены по парам слева направо (всего 21 пара). Далее типы зубов распределялись для внесения в систему скрининга по следующему алгоритму: во-первых, выбирались зубы, для которых чаще всего значения индексов оказывались CAL ≥ 1 мм или PPD≥ 4 мм. Собаки, у которых нашлись такие изменения в этих зубах, исключались из дальнейшего анализа. Затем из оставшихся групп зубов снова выбирались те, в которых чаще остальных можно было найти CAL≥ 1 мм или PPD≥ 4 мм. Собаки, имеющие такие значения в этих группах зубов, исключались из исследования, и так до тех пор, пока не были исключены все подходящие собаки. На каждом этапе подсчитывалась чувствительность метода исходя из количества собак и количества поражённых зубов. Также для каждого шага мы высчитывали прогностический отрицательный показатель (NPV) — вероятность того, что собака не будет иметь CAL (или PPD), если результаты теста отрицательные.
Собаки, у которых нашлись такие изменения в этих зубах, исключались из дальнейшего анализа. Затем из оставшихся групп зубов снова выбирались те, в которых чаще остальных можно было найти CAL≥ 1 мм или PPD≥ 4 мм. Собаки, имеющие такие значения в этих группах зубов, исключались из исследования, и так до тех пор, пока не были исключены все подходящие собаки. На каждом этапе подсчитывалась чувствительность метода исходя из количества собак и количества поражённых зубов. Также для каждого шага мы высчитывали прогностический отрицательный показатель (NPV) — вероятность того, что собака не будет иметь CAL (или PPD), если результаты теста отрицательные.
Таблица 1. Распределение CAL и PPD среди собак/ зубов
мм | Потеря крепления зуба (CAL) | Глубина зондирования карманов (PPD) | ||||||
N =48 <2,5 лет | N =50 >2,5 лет | N =48 < 2,5 лет | N =50 >2,5 лет | |||||
% собак | % зубов | % собак | % зубов | % собак | % зубов | % собак | % зубов | |
0 | 66,7 | 98,5 | 22,0 | 88,9 | ||||
1 | 10,4 | 0,7 | 16,0 | 0,9 | – | 46,2 | – | 28,8 |
2 | 18,8 | 0,8 | 16,0 | 4,0 | 4,2 | 45,1 | – | 47,3 |
3 | 2,1 | 0,1 | 6,0 | 2,1 | 56,3 | 7,1 | 26,0 | 14,8 |
4 | 2,1 | 0,1 | 22,0 | 2,3 | 31,3 | 1,4 | 32,0 | 6,0 |
5 | 8,0 | 0,9 | 8,3 | 0,2 | 24,0 | 1,8 | ||
6 | 6,0 | 0,6 | 12,0 | 0,9 | ||||
7 | 0,2 | 4,0 | 0,3 | |||||
8 | 4,0 | 0,1 | 0,10 | |||||
9+ | 2,0 | 0,1 | ||||||
Распределение по количеству зубов и количеству собак в зависимости от высшего показателя CAL и PPD среди зубов/ собак. Указано в соответствии с возрастом собак.
Указано в соответствии с возрастом собак.
Таблица 2. Распределение CAL и PPD среди собак
PPD ≥4 мм | PPD <4 мм | ||
CAL > 1 мм | 40 | 15 | 55 |
CAL < 1 мм | 16 | 27 | 43 |
общее кол-во собак | 56 | 42 | 98 |
Перекрёстный анализ собак в соответствии с наличием или отсутствием значений CAL ≥1 мм и PPD ≥4 мм
Рисунок 2. Выявление потери крепления зубов (CAL ≥1 mm). На оси Х представлена часть от общего числа собак/зубов с CAL ≥1 мм, которая была выявлена при последовательном осмотре. |
Результаты
У всех собак было не меньше 40 зубов, у 91% зубы полностью выросли. Причины, по которым некоторые собаки не имели зубов, неизвестны. В итоге у 55 собак (56%) значение CAL было больше 1 мм, и соотношение было больше у собак старше 2,5 лет (78%), чем у собак младше 2,5 лет (33%) (таблица 1). Аналогичная ситуация сложилась и с показателем PPD — значение больше 4 мм было выявлено у 56 собак (57%), и так же в основном этому оказались больше подвержены собаки старше 2,5 лет (74%), чем молодые (40%) (таблица 1). У собак до 2,5 лет относительно мало зубов имели показатели CAL ≥1 мм или PPD ≥4 мм, гораздо больше поражённых зубов встречалось у собак старше (таблица 1).
Из таблицы 2 видно, что, хотя количество собак с показателем CAL ≥1 мм практически идентично количеству собак с PPD ≥4 мм, совпадение между этими группами всё же не полное. То же самое можно наблюдать и в отношении количества самих зубов — число зубов с CAL ≥1 мм очень близко к числу зубов с PPD ≥4 мм, но не идентично. Это означает, что стратегия для выявления CAL ≥1 мм может отличаться от таковой для выявления PPD ≥4 мм.
Это означает, что стратегия для выявления CAL ≥1 мм может отличаться от таковой для выявления PPD ≥4 мм.
Рисунок 3. Выявление значений PPD ≥4 мм при использовании алгоритма для выявления CAL ≥1 мм. На оси Х представлена часть зубов/собак с PPD ≥4 мм, выявленных при последовательном осмотре. Указано в соответствии с возрастом |
Рисунок 4. Выявление значений PPD ≥4 мм. На оси Х представлена часть зубов/собак с PPD ≥4 мм, выявленных при последовательном осмотре. Указано в соответствии с возрастом |
Рисунок 5. Выявление значений CAL ≥1 мм при использовании алгоритма для выявления PPD ≥4 мм. На оси Х представлена часть зубов/собак с CAL ≥1 мм, выявленных при последовательном осмотре. Указано в соответствии с возрастом |
Разработка последовательных шагов для скрининга
Зубами, чаще всего имеющими значения показателя CAL ≥1 мм, оказалась верхнечелюстная 4-я пара премоляров (Man P4). Осмотр этих двух зубов выявил 54,5% всех собак с CAL ≥1 мм и 79,8% поражённых этим зубов во всей популяции (таблица 3, рисунок 2). Добавив к осмотру 2-ю и 3-ю пары верхнечелюстных премоляров, можно увеличить частоту обнаружения положительных на CAL ≥1 мм собак до 76,4%, а зубов — до 92,7%. Добавив ещё первую пару верхнечелюстных резцов, можно ещё увеличить эти цифры до 81,8% и 95,0% соответственно. Обнаружение всех поражённых собак и зубов потребует осмотра 11 из 21 пары зубов (таблица 3). На рисунке 2 можно увидеть, что для обеих возрастных групп наиболее вероятным местом обнаружения CAL ≥1 мм являются 2-я, 3-я и 4-я пара премоляров и 1-я пара резцов верхней челюсти. При добавлении к осмотру каких-либо других пар зубов мы получим слишком малый прирост выявляемости CAL ≥1 мм при большой затрате времени, что не соответствует целям нашего исследования. Скрининг на предмет CAL ≥1 мм только собак старше 2,5 лет оказывается немного чувствительнее, чем у более молодых собак (рисунок 2).
Осмотр этих двух зубов выявил 54,5% всех собак с CAL ≥1 мм и 79,8% поражённых этим зубов во всей популяции (таблица 3, рисунок 2). Добавив к осмотру 2-ю и 3-ю пары верхнечелюстных премоляров, можно увеличить частоту обнаружения положительных на CAL ≥1 мм собак до 76,4%, а зубов — до 92,7%. Добавив ещё первую пару верхнечелюстных резцов, можно ещё увеличить эти цифры до 81,8% и 95,0% соответственно. Обнаружение всех поражённых собак и зубов потребует осмотра 11 из 21 пары зубов (таблица 3). На рисунке 2 можно увидеть, что для обеих возрастных групп наиболее вероятным местом обнаружения CAL ≥1 мм являются 2-я, 3-я и 4-я пара премоляров и 1-я пара резцов верхней челюсти. При добавлении к осмотру каких-либо других пар зубов мы получим слишком малый прирост выявляемости CAL ≥1 мм при большой затрате времени, что не соответствует целям нашего исследования. Скрининг на предмет CAL ≥1 мм только собак старше 2,5 лет оказывается немного чувствительнее, чем у более молодых собак (рисунок 2).
Из таблицы 4 видно, что осмотр тех же пар зубов (Max P4, P3, P2 и I1) позволяет выявить 57,1% собак и 81,6% зубов с показателем PPD ≥4 мм. И снова скрининг только животных старше 2,5 лет оказался более чувствителен (рисунок 3), в то время как у молодых собак было выявлено менее половины всех поражённых собак/зубов.
И снова скрининг только животных старше 2,5 лет оказался более чувствителен (рисунок 3), в то время как у молодых собак было выявлено менее половины всех поражённых собак/зубов.
Чаще всего, показатель PPD оказывался больше 4 мм в нижнечелюстных резцах, и скрининг этой пары даёт выявление 57,1% процента всех собак и 81,6% всех зубов с таким значением. Эти цифры можно увеличить до 82,1% и 94,2% соответственно, добавив к осмотру верхнечелюстные резцы. Все собаки и все зубы с PPD ≥4 мм можно выявить, проверив 9 из 21 пары зубов (таблица 5). У собак старше 2,5 лет чувствительность к этому показателю будет выше, но добавление других пар зубов к осмотру не даст большого прироста выявляемости. Таблица 6 показывает, что осмотр клыков приведёт к идентификации 58,2% собак, а также 80,1% зубов положительных по CAL ≥1 мм. Скрининг только животных более 2,5 лет для CAL ≥1 мм имеет более высокую чувствительность, чем скрининг молодых собак (рисунок 5).
Таблица 3. Иерархическое распределение собак со значением CAL ≥1 мм
Иерархическое распределение собак со значением CAL ≥1 мм
* Max — maxilla, Man — mandibula, P — премоляры, I — резцы, С — клыки, M — моляры
Осмотренные зубные пары | Все собаки (N = 98) | ||
% CAL-положительных собак | % CAL-положительных зубов | NPV у собак | |
Max P4* | 54,5 | 79,8 | 0,63 |
+Max P3 | 70,9 | 89,7 | 0,73 |
+Max P2 | 76,4 | 92,7 | 0,77 |
+Max I1 | 81,8 | 95,0 | 0,81 |
+Max C | 85,5 | 96,2 | 0,84 |
+Man M1 | 8,0 | 97,3 | 0,88 |
+Man I1 | 92,7 | 98,5 | 0,91 |
+Man P4 | 94,5 | 98,9 | 0,93 |
+Man M2 | 96,4 | 99,2 | 0,96 |
+Man P2 | 98,2 | 99,6 | 0,98 |
+Man I3 | 100,0 | 100,0 | 1,00 |
Соотношение общего числа CAL≥1-положительных собак и зубов, выявленных в соответствии с вероятно поражёнными зубными парами (чувствительность). Также для каждой комбинации указано соответствующий коэффициент NPV-негативных собак, у которых действительно не было выявлено CAL ≥1 мм.
Также для каждой комбинации указано соответствующий коэффициент NPV-негативных собак, у которых действительно не было выявлено CAL ≥1 мм.
Таблица 4. Наличие значений PPD ≥4 мм при использовании алгоритма для выявления CAL ≥1 мм
Осмотренные зубные пары | Все собаки (N = 98) | |
% PPD -положительных собак | % PPD -положительных зубов | |
Max P4 | 37,5 | 67,3 |
+Max P3 | 51,8 | 78,9 |
+Max P2 | 53,6 | 80,3 |
+Max I1 | 57,1 | 81,6 |
+Max C | 58,9 | 82,1 |
+Man M1 | 62,5 | 83,4 |
+Man I1 | 64,3 | 85,6 |
+Man P4 | 66,1 | 86,1 |
+Man M2 | 67,9 | 87,9 |
+Man P2 | 69,6 | 88,3 |
+Man I3 | 71,4 | 89,2 |
Соотношение общего числа собак и зубов с PPD ≥4 мм, выявленных при проведении скрининга на CAL ≥1 мм (чувствительность).
Таблица 5. Иерархическое распределение собак со значением PPD ≥4 мм.
Осмотренные зубные пары | Все собаки (N = 98) | ||
% PPD-положительных собак | % PPD-положительных зубов | NPV собак | |
Man C | 57,1 | 81,6 | 0,64 |
+Max C | 82,1 | 94,2 | 0,81 |
+Max I2 | 85,7 | 95,5 | 0,84 |
+Man P4 | 89,3 | 96,4 | 0,88 |
+Max M2 | 92,9 | 97,3 | 0,91 |
+Max P4 | 95,5 | 97,8 | 0,93 |
+Max P3 | 96,4 | 98,7 | 0,95 |
+Max P2 | 98,2 | 99,6 | 0,98 |
+Max I1 | 100 | 100 | 1,00 |
Соотношение общего числа PPD≥4-положительных собак и зубов, выявленных в соответствии с вероятно поражёнными зубными парами (чувствительность). Также для каждой комбинации указано соответствующий коэффициент NPV-негативных собак, у которых действительно не было выявлено PPD ≥4 мм.
Также для каждой комбинации указано соответствующий коэффициент NPV-негативных собак, у которых действительно не было выявлено PPD ≥4 мм.
Таблица 6. Выявление значений CAL ≥1 мм при использовании алгоритма для выявления PPD ≥4 мм
Все собаки (N = 98) | ||
% CAL-положительные собаки | % CAL –положительные зубы | |
Man C | 49,1 | 69,5 |
+Max C | 58,2 | 80,1 |
+Max I2 | 60,0 | 82,1 |
+Man P4 | 63,4 | 82,8 |
+Max M2 | 65,5 | 83,2 |
+Max P4 | 67,3 | 84,7 |
+Max P3 | 69,1 | 85,9 |
+Max P2 | 70,9 | 88,2 |
+Max I1 | 72,7 | 88,9 |
Соотношение общего числа собак и зубов с PPD ≥4 мм, выявленных при проведении скрининга на CAL ≥1 мм (чувствительность).
Обсуждение
Скрининг на пародонтоз должен быть быстрым, простым и точным способом осмотра нескольких зубов, способным выявлять поражённых животных. Собаки, у которых в результате скрининга были выявлены отклонения, должны проходить осмотр всей полости рта.
Данное исследование показало, что осмотр пяти верхнечелюстных пар зубов P4, P3, P2, I1 и С позволяет выявить 85,5% всех собак и 96% всех зубов с CAL ≥1 мм (таблица 3) и 58,9% всех собак и 82,1% всех зубов с PPD >4 мм (таблица 4). Осмотр пяти пар зубов, верхнечелюстных I2, M2 и C и нижнечелюстных C и P4 позволяет выявить 92,9% всех собак и 97,3% всех зубов с PPD ≥4 мм (таблица 5), и 65% всех собак и 83,2% всех зубов с CAL ≥1 мм (таблица 6). Таким образом, у биглей основную часть зубов с CAL ≥1 мм и PPD ≥4 мм можно выявить, осмотрев верхнечелюстные пары P4, P3, P2, I1 и C, если мы ищем CAL ≥1 мм, или все клыки, верхнечелюстные I2, M2 и нижнечелюстные P4, если ищем PPD ≥4 мм. Прежде, чем решить, на предмет чего мы хотим провести скрининг, нам необходимо выбрать, что является нашей целью — выявить наличие поражения периодонта у собаки или разработать план лечения. В первом случае необходимо провести скрининг на CAL ≥1 мм, во втором — на PPD ≥4 мм. Однако следует держать в уме, что результаты, представленные здесь, достоверно относятся только к данной популяции собак. В предыдущих исследованиях мы выявили, что есть зубы, наиболее подверженные увеличению CAL и PPD. У пуделей такими зубами оказались клыки и верхнечелюстные P4 [17]. В исследованиях на других породах было выявлено, что чаще всего увеличение CAL происходит для клыков, в то время как самые большие значения CAL отмечались для верхнечелюстных P4 и моляров [16]. Глубокие периодонтальные каналы чаще всего обнаруживались на клыках, резцах и верхнечелюстных P4 у мелких пород [18], но в другом исследовании на биглях такими зубами оказались нижнечелюстные P4 [24]. Наконец, в одном из последних исследований на домашних животных было выявлено, что признаки пародонтопатии на верхней челюсти обнаруживались чаще, чем на нижней [25]. Таким образом, протокол скрининга, предложенный здесь, необходимо проверить и на других популяциях животных, чтобы его можно было считать достоверным и универсальным для всех пород методом.
Чем больше зубов будет осмотрено, тем больше будет получено информации, и тем ближе она будет к реальной ситуации. Точкой преткновения здесь является время анестезии. Всё же, если мы прибегаем к частичному осмотру, потеря определённой доли информации неизбежна. Вопрос в том, насколько приемлемой будет эта потеря, учитывая время, которое мы затрачиваем на проведение скрининга. Если больная собака оказалась негативной в данном тесте, и не прошла из-за этого полного осмотра ротовой полости, некоторые поражённые зубы, отличные от включённых в протокол скрининга, могут быть пропущены. В нашем понимании, «лучшим» методом для осмотра будет тот, при котором необходимый объём осмотра рассчитывается исходя из субъективной оценки.
В заключение данного исследования надо уточнить, что мы сделали два допущения, справедливость которых может быть оспорена. Мы взяли за основу значение CAL≥ 1 мм, в то время как в человеческой медицине в описанных привычных местах признаком поражения периодонта является значение CAL≥ 3 мм. Тем не менее, последнее правило появилось весьма произвольно и без серьёзных доказательств [26, 27], и его использование может привести к невыявлению существующей пародонтопатии. По нашему мнению, со временем этот факт будет осознан и принят. Что касается глубины зондирования карманов, тут нет какой-то определённой природной нулевой точки, так что мы произвольно взяли величину в 4 мм и более как положительный результат. Эта цифра соотносится с таковой в человеческой медицине, но это решение определённо предстоит обсудить в контексте других популяций животных, поскольку у людей эта величина определяет то, на какую глубину может углубиться ворсинка зубной щётки при чистке зубов. Далее, природные механизмы очистки зубов не работают на глубине кармана ≥ 4 мм, поэтому таким животным необходим особый уход за полостью рта. И, наконец, тот факт, что мы нашли достаточно мало зубов с PPD ≥ 4 мм у молодых собак, говорит о том, что наше определение «поражённого» зуба удовлетворяет клиническим нуждам.
Выводы
Данный протокол скрининга подходит для больших групп лабораторных биглей и наше исследование показало, что он имеет достаточно высокую чувствительность. Для скрининга на CAL ≥1 мм необходимо проверять пары зубов P4, P3, P2, I1 и C верхней челюсти, а на PPD ≥4 мм — верхнечелюстные I2, M2, нижнечелюстные P4 и все клыки. Эта процедура обычно занимает несколько минут. Чувствительность метода будет выше, если скрининг проводить только на собаках старше 2,5 лет. Могут существовать свои особенности к подверженности разных зубов к проявлениям пародонтопатии у разных пород. Прежде чем использовать этот метод в общей практике, его необходимо опробовать на других породах собак и популяциях больших размеров.
Благодарности
Авторы благодарят Helle Harding Poulsen, DVM, Ph.D за предоставление нам протоколов анестезии и проведение анестезии во всех случаях в ходе исследования.
Литература
1. DeBowes LJ, Mosier D, Logan E, Harvey CE, Lowry S, Richardson DC: Association of periodontal disease and histologic lesions in multiple organs from 45 dogs. J Vet Dent 1996, 13:57–60.
2. Pavlica Z, Petelin M, Juntes P, Erzen D, Crossley DA, Skaleric U: Periodontal disease burden and pathological changes in organs of dogs. J Vet Dent 2008, 25:97–105.
3. Kouki M, Papadimitriou SA, Kazakos GM, Savas I, Bitchava D: Periodontal disease as a potential factor for systemic inflammatory response in the dog. J Vet Dent 2013, 30:26–29.
4. Rawlinson JE, Goldstein RE, Reiter AM, Attwater DZ, Harvey CE: Association of periodontal disease with systemic health indices in dogs and the systemic response to treatment of periodontal disease. J Am Vet Med Assoc 2011, 238:601–609.
5. Whyte A, Bonastre C, Monteagudo LV, Les F, Obon J, Whyte J, Tejedor MT: Canine stage 1 periodontal disease: a latent pathology. Vet J 2014, 201:118–120.
6. Cullinan MP, Seymour GJ: Periodontal disease and systemic illness: will the evidence ever be enough? Periodontol 2000, 2013, 62:271–286.
7. Gulati M, Anand V, Jain N, Anand B, Bahuguna R, Govila V, Rastogi P: Essentials of periodontal medicine in preventive medicine. IntJ Prev Med 2013, 4:988–994.
8. Otomo-Corgel J, Pucher JJ, Rethman MP, Reynolds MA: State of the science: chronic periodontitis and systemic health. J Evid Base Dent Pract 2012, 12:20–28.
9. Freitas COT, Gomes-Filho IS, Naves RC, Nogueira Filho GR, Cruz SS, Santos CAST, Dunningham L, Miranda LF, Barbosa MDS: Influence of periodontal therapy on C-reactive protein level: a systematic review and metaanalysis. JApplOral Sci 2012, 20:1–8.
10. Harvey C, Emily PP: Periodontal disease. In Small Animal Dentistry. 1st edition. Edited by Harvey C, Emily PP. Missouri: Mosby; 1993:89–144.
11. Gorrel C, Robinson J: Oral examination and radiography. In Manual of Small Animal Dentistry. 2nd edition. Edited by Crossley DA, Penman S. Cheltenham: BSAVA; 1995:35–49.
12. Dupont GA, DeBowes LJ: Radiographic evidence of pathology: periodontal disease. In Atlas of dental radiography in dogs and cats. 1st edition. Edited by Dupont GA, DeBowes LJ. St. Louis, Missouri: Elsevier; 2009:134–141.
13. Tsugawa A, Verstraete F, Kass P, Gorrel C: Diagnostic value of the use of lateral and occlusal radiographic views in comparison with periodontal probing for the assessment of periodontal attachment of the canine teeth in dogs. J Vet Res 2003, 64:255–261.
14. Verstraete F, Kass P, Terpak C: Diagnostic value of full-mouth radiography in dogs. Am J Vet Res 1998, 59:686–691.
15. Kortegaard HE, Eriksen T, Baelum V: Periodontal disease in research Beagle dogs — an epidemiological study. J Small Anim Pract 2008,49:610–616.
16. Harvey CE, Shofer FS, Laster L: Association of age and body weight with periodontal disease in North American dogs. J Vet Dent 1994, 11:94–105.
17. Hoffmann T, Gaengler P: Epidemiology of periodontal disease in poodles. J Small Anim Pract 1996, 37:309–316.
18. Sarkiala E, Asikaineb S, Wolf J, Kanervo A, Happonen I, Jousimies-Somer H: Clinical, radiological and bacteriological findings in canine periodontitis. J Small Anim Pract 1993, 34:265–270.
19. Anerud KE, Robertson PB, Loe H, Anerud LA, Boysen HM, Patters MR: Periodontal diseases in three young adult populations. J Periodont Res 1983, 18:655–668.
20. Baelum V, Fejerskov O, Manji F: Periodontal diseases in adult Kenyans. J Clin Periodontol 1988, 15:445–452.
21. Baelum V: Pattern of periodontal breakdown in adult Tanzanians. Scand J Dent Res 1987, 95:221–228.
22. Harvey CE, Laster L, Shofer FS, Miller B: Scoring the full extent of periodontal disease in the dog: development of total mouth periodontal score (TMPS) system. J Vet Dent 2008, 25:176–180.
23. Harvey CE, Laster L, Shofer FS: Validation of use of subsets of teeth when applying total mouth periodontal score (TMPS) system in dogs. J Vet Dent 2012, 29:222–226.
24. Sorensen WP, Loe H, Ramfjord SP: Periodontal disease in the Beagle dog: a cross sectional study. J Periodont Res 1980, 15:380–389.
25. Kyllar M, Witter K: Prevalence of dental disorders in pet dogs. Vet Med-Czech 2005, 50:496–505.
26. Baelum V, Lopez R: Defining and classifying periodontitis: need for a paradigm shift? Eur J Oral Sci 2003, 111:2–6.
27. Van der Velden U: Diagnosis of periodontitis. J Clin Periodontol 2000, 27:960–961.
Источник: Acta Veterinaria Scandinavica 2014, 56:77. Licensee BioMed Central Ltd. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly credited. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
СВМ № 3/2016
Оценить материал
НравитсяНравится Поздравляю Сочувствую Возмутительно Смешно Задумался Нет слов
Обзор периодонтопатогенного возбудителя ниже линии десен
Front Microbiol. 2016; 7: 53.
Kah Yan How
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
Кеанг Пенг Сонг
2 Школа Science, Университет Монаш, кампус Sunway, Субанг-Джая, Малайзия
Кок Ган Чан
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
2 Школа естественных наук, Университет Монаш Кампус Санвей, Субанг Джая, Малайзия
Отредактировал: Laurel L .Ленц, Медицинский факультет Университета Колорадо, США
Рецензент: Пол Фиш, Медицинский центр Университета Фрайбурга, Германия; Чарльз С. Колдуэлл, Университет Цинциннати, США
Эта статья была отправлена в Microbial Immunology, раздел журнала Frontiers in Microbiology
Поступила 31 октября 2015 г .; Принято 12 января 2016 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) или лицензиара и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Заболевания пародонта представляют собой группу воспалительных инфекций полости рта, вызываемых патогенами полости рта, которые существуют в виде сложных биопленок на поверхности зуба и вызывают разрушение опорных тканей зуба.Тяжесть этого заболевания варьируется от легкого и обратимого воспаления десен (гингивита) до хронического разрушения соединительных тканей, образования пародонтального кармана и, в конечном итоге, приводит к потере зубов. В то время как поддесневой налет человека содержит более 500 видов бактерий, обширные исследования показали, что Porphyromonas gingivalis , грамотрицательная анаэробная бактерия, является основным этиологическим агентом, вызывающим хронический пародонтит. Эта бактерия с черным пигментом продуцирует множество факторов вирулентности, которые прямо или косвенно вызывают разрушение тканей пародонта, модулируя воспалительную реакцию хозяина.Здесь в этом обзоре представлен обзор P. gingivalis и того, как его факторы вирулентности влияют на патогенез с другим консорциумом микробиома в полости рта.
Ключевые слова: Porphyromonas gingivalis , оральный возбудитель, пародонтоз, гингивит, факторы вирулентности, воспалительная реакция
Введение
Заболевания пародонта — сложные, многофакторные, полимикробные инфекции, характеризующиеся разрушением поддерживающих зуб тканей.Заболевание начинается с острого воспаления десневой ткани и невылеченных инфекций, которые могут прогрессировать до образования карманов в зубах и, в конечном итоге, потери зубов. По данным Всемирной организации здравоохранения, заболевания пародонта поражают 10–15% взрослого населения во всем мире (Petersen and Ogawa, 2012).
Существенные данные, накопленные за эти годы, указывают на участие лишь небольшой части бактерий, обитающих в поддесневой нише, в возникновении и прогрессировании заболеваний пародонта.Существуют убедительные доказательства, указывающие на Porphyromonas gingivalis , грамотрицательные анаэробы, как на ключевой вид в развитии хронического пародонтита.
В последние десятилетия обширных исследований P. gingivalis были получены различные доказательства вклада этого анаэроба в прогрессирование периондонта. Эти данные важны для улучшения нашего понимания характеристик вирулентности и клеточного взаимодействия между P.gingivalis и хозяина, тем самым выясняя потенциальные терапевтические подходы к контролю прогрессирования заболеваний пародонта.
Флора ротовой полости и нормальный периодонт
Ротовая полость обладает рядом особенностей, которые делают ее особой средой обитания для целого зверинца микроорганизмов. Поверхности ротовой полости большую часть времени непрерывно омываются слюной в узком диапазоне температур (от 34 до 36 ° C) и pH, близком к нейтральному (Marcotte and Lavoie, 1998). Обнаружено, что в такой идеальной среде различные классы микрофлоры распределены в различных экологических нишах (Parahitiyawa et al., 2010).
В целом во рту обитает не менее шести миллиардов бактерий, которые представлены более чем 700 видами (Theilade, 1990; Aas et al., 2005), а также другими типами микроорганизмов, включая грибы, микоплазмы, простейшие и возможно, даже вирусы (Pennisi, 2005). Как правило, бактерии полости рта можно в широком смысле классифицировать как грамположительные и грамотрицательные бактерии, а также как анаэробные или факультативно анаэробные в соответствии с их потребностями в кислороде. Некоторые из наиболее часто выделяемых микроорганизмов в ротовой полости человека перечислены в таблице Таблица .
Таблица 1
Преобладающая микробиота полости рта человека.
| Группа микробов | Род / вид микробов |
|---|---|
| Грам-положительный | |
| Аэробный или факультативный | Стрептококк (S. gordonii, S. mitis, S. auralis, S. salivarius) |
| Стафилококк (S. aureus, S. epidermidis) | |
| Энтерококк (E.faaecalis) | |
| Lactobacillus (L. casei, L. fermentum) | |
| Коринебактерии (C. matruchotii) | |
| Actinomyces (A. naeslundii, A. israelli, A. viscosus) | |
| Арахния (A. propionica) | |
| Ротия (R. dentocariosa) | |
| Облигатные анаэробы | Bacillus (B.cereus) |
| Propionibacterium (P. acnes) | |
| Пептострептококк (P. micros, P. anaerobius) | |
| Грамотрицательные | |
| Аэробный или факультативный | Campylobacter (C. rectus, C. concisus, C. gracilis) |
| Actinobacillus (A. actinomycetemcomitans) | |
| Облигатные анаэробы | Fusobacterium (F.nucleatum) |
| Porphyromonas (P. gingivalis) | |
| Prevotella (P. melaninogenica, P. oralis, P. intermedia) |
микробиота, ротовая полость, тем не менее, характеризуется стабильным сообществом, известным как сообщество климакса. Следовательно, если возникает дисбаланс в микробиоте, постоянно проживающей в ротовой полости, появляются такие заболевания полости рта, как кариес и заболевания пародонта, что приводит к размножению потенциально патогенных микроорганизмов.Несколько исследований показали, что изменение видов микробов в десневой борозде с грамположительных, факультативных, ферментативных микроорганизмов на преимущественно грамотрицательные, анаэробные, хемоорганотрофные и протеолитические организмы в значительной степени связано с разрушением тканей пародонта (Eloe-Fadrosh and Раско, 2013).
Заболевания пародонта
Заболевания пародонта обычно относятся к воспалительному патологическому состоянию десны и поддерживающих структур пародонта, включая десну, альвеолярную кость, периодонтальную связку и цемент.Они обычно встречаются в большинстве человеческих популяций и приводят к значительной заболеваемости с отслаиванием зубов в тяжелом состоянии. В Соединенных Штатах последние эпидемиологические данные показывают, что заболевание периондонта поражает половину населения в возрасте старше 30 лет и является основной причиной потери зубов среди взрослых (Bostanci and Belibasakis, 2012). Согласно системе классификации заболеваний пародонта, предложенной Американской академией пародонтологии (AAP), заболевания пародонта обычно делятся на две основные категории: заболевания десен и пародонтит, в зависимости от того, произошло ли разрушение прикрепления пародонта (Wiebe and Putnins, 2000). ).
Заболевание десен определяется как воспаление тканей десны, вызванное скоплением зубного налета, и клинически характеризуется покраснением, отеком и кровотечением тканей. Поскольку периодонтальная связка и альвеолярная кость не вовлечены в это событие, прикрепление зубов не затрагивается (Williams et al., 1992). Гингивит может сохраняться неопределенно долго в течение длительного периода и не перерастет в пародонтит, если нет нарушений местных условий или общей восприимчивости хозяина (Offenbacher, 1996).
С другой стороны, пародонтит относится к необратимому воспалению тканей пародонта, вызванному бляшками, которое приводит к разрушению периодонтальной связки и альвеолярной кости и миграции эпителиальной связки. Впоследствии это вызывает образование пародонтального кармана, что является основным клиническим признаком пародонтита (Williams et al., 1992). Этот карман является идеальной поверхностью для бактериальной колонизации и образования поддесневого налета.
Различные исследования показали, что пародонтит чаще встречается у пациентов с системными заболеваниями, такими как сахарный диабет, СПИД, лейкемия и синдром Дауна (Komatsu, 2014; Mehta, 2015).Все больше данных свидетельствует о том, что пародонтит может повышать риск нескольких потенциально смертельных состояний, включая сердечно-сосудистые заболевания (например, сердечный приступ, ишемическую болезнь сердца и инсульт) и диабет (Saremi et al., 2005; Friedewald et al., 2009) . Согласно отчету AAP в 1996 году, было обнаружено, что люди с некоторыми формами заболеваний десен почти в два раза чаще страдают ишемической болезнью сердца по сравнению с людьми со здоровыми деснами.
В течение многих лет проводились многочисленные исследования, показывающие возможную связь между заболеваниями пародонта и сердечно-сосудистыми заболеваниями.Недавние исследования, такие как исследование Nakano et al. (2006) попытались показать прямые механизмы, связывающие заболевания пародонта с сердечно-сосудистыми заболеваниями. Для объяснения этой ассоциации был предложен ряд механизмов, включая общий фактор, который предрасполагает некоторых людей к гипервоспалительной реакции при сердечно-сосудистых заболеваниях (Beck et al., 1996). Считается, что оральные патогены могут попадать в кровоток, а воспаление, вызванное заболеваниями пародонта, увеличивает образование зубного налета, что впоследствии способствует расширению артерий (Bartold and Narayanan, 2006). На рисунке показана упрощенная диаграмма потенциальных ролей, которые воспаление пародонта может играть в патогенезе сердечно-сосудистых заболеваний.
Упрощенное изображение, показывающее связь хронического воспаления пародонта и патогенеза сердечно-сосудистых заболеваний. По материалам Bartold and Narayanan (2006).
Streptococcus mutans , основной патогенный агент кариеса зубов, обнаруживался с необычно высокой частотой как в тканях сердечного клапана, так и в образцах атероматозных бляшек, чем любые другие виды (Nakano et al., 2006). Фактически, вместе с P. gingivalis ранее было обнаружено, что S. mutans ускоряет образование атерогенных бляшек на мышиной модели и вызывает агрегацию тромбоцитов, что предположительно приводит к образованию тромба (Herzberg and Meyer, 1996; Kuramitsu et al., 2001 ). Последнее исследование Oliveira et al. (2015) показали, что S. mutans, Prevotella intermedia, P. gingivalis и Treponema denticola часто обнаруживались в образцах сердечного клапана с использованием метода полимеразной цепной реакции (ПЦР), что подтверждает предыдущие выводы.Высокая частота обнаружения S. mutans в образцах зубного налета может свидетельствовать о том, что S. mutans , обнаруженные в образцах клапана, произошли из полости рта. Однако есть опасения по поводу возможности обнаружения ДНК мертвых бактерий из-за высокой чувствительности ПЦР в реальном времени.
С другой стороны, Американская кардиологическая ассоциация отметила, что ни пародонтоз не вызывает атеросклеротическое заболевание сосудов, ни лечение пародонта не предотвращает атеросклеротическое сосудистое заболевание (Lockhart et al., 2012). Это было подтверждено отчетом Hayashi et al. (2015), в которых отсутствует сильная корреляция между состоянием пародонта и параметрами статуса артериосклероза у пациентов с ишемической болезнью сердца. Однако это исследование также имеет некоторые ограничения, например, пациенты без ишемической болезни сердца были исключены, а образцы биомаркеров не были собраны из разных областей полости рта, чтобы отразить местные воспалительные состояния.
Сообщалось, что заболевания пародонта и сердечно-сосудистые заболевания имеют общие факторы риска, такие как курение, сахарный диабет, старение и ожирение (Genco and Borgnakke, 2013).Системные воспалительные маркеры также были обнаружены при обоих заболеваниях. Следовательно, доказательство корреляции между этими двумя заболеваниями остается сложной задачей. Другие общие факторы, включая образ жизни и личную гигиену, также сыграли важную роль в обоих заболеваниях. Из-за большого количества противоречивой литературы существует необходимость в дополнительных долгосрочных исследованиях, чтобы установить сильную причинную связь между заболеваниями пародонта и сердца.
Помимо сердечно-сосудистых заболеваний, исследования in vitro, и модели на животных предполагают, что P.gingivalis может нарушать иммунную толерантность у восприимчивых людей и усугублять ревматоидный артрит за счет ферментативной модификации белков хозяина (Maresz et al., 2013). Кроме того, было обнаружено, что пародонтоз является фактором риска для недоношенных детей с низкой массой тела при рождении (Ali and Abidin, 2012). Медиаторы воспаления, возникающие при пародонтозе, играют решающую роль в инициировании родов, и существуют вероятные механизмы, которые могут связать эти два состояния (Williams et al., 2000). Основываясь на эпидемиологических и микробиологических иммунологических исследованиях, постулируемые механизмы включают транслокацию патогенов пародонта в фетоплацентарную единицу и действие пародонтального резервуара факторов вирулентности в качестве медиаторов воспаления. Однако взаимосвязь между неблагоприятными исходами беременности и ответом материнских антител на P. gingivalis требует дальнейшего изучения (Madianos et al., 2013).
Бактериальная этиология заболеваний пародонта
За эти несколько десятилетий были достигнуты большие успехи в понимании патогенеза и естественного течения заболеваний пародонта.Тем не менее, исследования, проведенные в 1930-1970-х годах, не смогли идентифицировать конкретные бактерии как этиологические агенты заболеваний пародонта. Таким образом, была предложена «неспецифическая теория», которая выдвигает гипотезу о том, что заболевание пародонта вызвано консорциумом микроорганизмов, а не важностью каких-либо видов бактерий как единственных возбудителей (Theilade, 1986). Однако в конце 1970-х и позже были выделены более специфические микроорганизмы в качестве этиологических агентов пародонтита (Tanner et al., 1979; Слотс и др., 1986; Мур и Мур, 1994).
В настоящее время широко признано, что мириады бактерий, а не ни один микроорганизм, вовлечены в заболевания пародонта. Фактически, воспаление тканей пародонта вызвано колонизацией поддесневой области бактериями пародонта. Например, на поверхности зубов ранними или первичными колонизаторами являются в основном стрептококки и актиномицеты. Со временем пропорции этих грамположительных факультативно анаэробных бактерий уменьшаются, и в конечном итоге грамотрицательные анаэробы становятся более устойчивыми, особенно на границе раздела зубов и десен (Jenkinson and Lamont, 2006).
Тем не менее, сложные взаимодействия между бактериальной флорой и защитными механизмами хозяина существенно влияют на баланс между бактериальной агрессией и защитой хозяина и, таким образом, определяют, происходит ли разрушение пародонта (Hajishengallis et al., 2012). В свете этих критериев ряд экспериментальных данных продемонстрировал, что первичными этиологическими агентами заболеваний пародонта обычно являются грамотрицательные палочки, которые включают Actinobacillus actinomycetemcomitans, Tannerella forsythia (ранее обозначенные как Bacteroides forsythus ), Prevotella, Fusobacterium , и P.gingivalis. Ни один из этих видов микробов не способен вызывать деструктивные события, связанные с прогрессированием заболеваний пародонта, но этиология требует согласованного взаимодействия этих членов для создания своих ниш в полости рта (Marcotte and Lavoie, 1998; Maiden et al., 2003; Paster et al., 2006).
Porphyromonas Gingivalis и его распространенностьСреди основных патогенов пародонта P. gingivalis , по-видимому, является одним из основных этиологических агентов в патогенезе и прогрессировании воспалительных явлений пародонтоза (Hajishengallis et al., 2012). Эта пародонтопатическая бактерия была обнаружена в 85,75% образцов поддесневого налета от пациентов с хроническим пародонтитом (Datta et al., 2008). Эта неподвижная асахаролитическая грамотрицательная бактерия представляет собой облигатно анаэробную палочку, которая образует колонии с черным пигментом на чашках с кровяным агаром (, фиг. ). В процессе роста ему абсолютно необходимо железо. Ранее он назывался Bacteroides gingivalis до его реклассификации в новый род Porphyromonas (Nisengard and Newman, 1994).Название Porphyromonas происходит от греческого прилагательного porphyreos , означающего пурпурный, и греческого существительного monas , означающего единицу. Следовательно, слово Porphyromonas означает порфириновые клетки, поскольку колонии на пластинах с кровяным агаром становятся черными через 6–10 дней из-за накопления гема (Shah and Collins, 1988).
Черные пигментированные колонии пародонтопатогена P. gingivalis на агаре с лошадиной кровью. Считается, что пигмент связан с накоплением гемина (окисленной формы гема) на поверхности клеток при выращивании на кровяном агаре.
Основным местом обитания P. gingivalis является поддесневая борозда ротовой полости человека. Он основан на ферментации аминокислот для производства энергии, свойства, необходимого для его выживания в глубоком периодонтальном кармане, где доступность сахара низкая (Bostanci and Belibasakis, 2012). Являясь облигатным анаэробом, P. gingivalis служит вторичным колонизатором зубного налета, часто прилипая к первичным колонизаторам, таким как Streptococcus gordonii и P.промежуточный. Исследование Bodet et al. (2006) продемонстрировали, что эта асахаролитическая бактерия связана с T. denticola и T. forsythia с образованием комплекса красных бактерий, который широко распознается при поздних поражениях пародонта. Дополнительные доказательства присутствия P. gingivalis также получены из иммунологических исследований (Moore et al., 1991; Schmidt et al., 2014). Практически все исследователи согласны с тем, что уровни сывороточных антител к P. gingivalis выше у пациентов с диагнозом пародонтит у взрослых (Mahanonda et al., 1991; Casarin et al., 2010).
В последние несколько десятилетий штамм P. gingivalis были классифицированы на инвазивные и неинвазивные штаммы на основе их способности образовывать абсцессы на модели мышей. Было продемонстрировано, что инвазивный штамм P. gingivalis обладает большей патогенной активностью, чем неинвазивный штамм как in vitro , так и in vivo (Dorn et al., 2000; Baek et al., 2015).
Наличие п.gingivalis , действующий либо отдельно, либо как смешанная инфекция с другими оральными патогенами, и, возможно, дефицит определенных иммунологических факторов у хозяина, по-видимому, имеет важное значение для этиологии прогрессирующего пародонтита (Haffajee and Socransky, 1994). Было показано, что количество P. gingivalis значительно увеличивается в участках с пародонтитом и ниже или не обнаруживается на участках с поддесневым здоровьем или гингивитом, связанным с бляшками (Schmidt et al., 2014). Обычно он в большей степени находится в глубоких, чем в неглубоких пародонтальных карманах (Ali et al., 1996). Около 40–100% взрослых пациентов с пародонтитом инфицированы этими условно-патогенными бактериями.
При высокой частоте встречаемости P. gingivalis в очагах пародонтита у взрослых имеется сильная гипотеза, что P. gingivalis взаимодействуют с другими членами микробиоты хозяина, синтезируя различные патогенные факторы, что приводит к прогрессированию заболевания. Однако то, как P. gingivalis взаимодействует с селективными клетками-хозяевами для производства деструктивных биологических молекул и запускает преобразование здоровой ткани ротовой полости в болезненное состояние, еще неизвестно (Holt et al., 1999).
Факторы вирулентности
P. gingivalisИндукция и прогрессирование деструкции тканей пародонта представляют собой сложные процессы, включающие накопление бляшек, высвобождение бактериальных веществ и воспалительную реакцию хозяина. P. gingivalis , как известно, продуцирует набор факторов вирулентности, которые могут проникать в десны и вызывать разрушение тканей прямо или косвенно, вызывая воспаление (Hajishengallis et al., 2012). Факторы вирулентности можно определить как компоненты или метаболиты организма, которые необходимы на различных стадиях жизненного цикла и вызывают повреждение хозяина.Способность организма колонизировать и уклоняться от антибактериальных защитных механизмов хозяина, а также способность производить вещества, которые могут инициировать разрушение тканей, являются неотъемлемыми характеристиками успешного патогена. Некоторые факторы вирулентности приведены в Таблице .
Таблица 2
Факторы вирулентности и эффекторы хозяина, продуцируемые P. gingivalis.
| Факторы вирулентности | Влияние на уклонение от хозяина |
|---|---|
| Ферменты (гиалуронидаза, хондроитинсульфатаза), капсула | Снижение фагоцитоза для инвазии, ингибиторы хемотаксиса B |
| Фимбрии, экзополисахарид, белки внешней мембраны | Адгезия или прикрепление к внешней мембране хозяина |
| Коллагеназа, трипсиноподобная протеаза, желатиназа | Деградация ингибиторов протеаз плазмы, разрушение ткани пародонта |
| Аминопептидаза | Деградация белка транспорта железа |
Чтобы выжить и размножаться в организме хозяина, вторгающемуся патогену необходимо преодолеть внешние защитные барьеры хозяина, прежде чем он сможет найти подходящую экологическую нишу для колонизации.Колонизация тканей хозяина могла происходить только в присутствии факторов вирулентности, таких как фимбрии, капсулы, липополисахарид (ЛПС), липотейхоевые кислоты, гемагглютинины, гингипаины, белки внешней мембраны и везикулы внешней мембраны (Holt et al., 1999; Hajishengallis and Ламонт, 2014). Выражение факторов вирулентности часто регулируется в ответ на изменения во внешней среде пародонтопатогена. Если эти факторы вирулентности активны в восприимчивом хозяине, они могут привести к быстрому и значительному разрушению тканей пародонта, резорбции костей, индукции ответов хозяина за счет продукции цитокинов, а также к ингибированию защитных механизмов хозяина.Однако экспрессия этих детерминант вирулентности и их механизм на различных стадиях заболевания пародонта широко не исследовались. Для полного понимания конкретной функции каждого фактора и его механизма в патогенезе требуется инактивация факторов в сочетании с биохимической оценкой и тестированием на вирулентность in vivo и .
Капсулы
Чтобы прижиться в полости рта, микроорганизмы должны сначала прикрепиться к зубам или поверхностям слизистой оболочки (Yoshimura et al., 2009). Соблюдение режима лечения необходимо для обеспечения сопротивления потоку слюны. Приверженность обычно опосредуется адгезинами на поверхности бактерий и рецепторами на поверхности полости рта. Микробные адгезины обнаруживаются как компоненты клеточной стенки или связаны с клеточными структурами, такими как капсулы или фимбрии (Marcotte and Lavoie, 1998). Химический состав капсулы у разных штаммов различается, главным образом, по составу сахара. Например, P. gingivalis ATCC 53977 не содержит галактозу, но богат аминосахарами. P. gingivalis обнаруживает, по крайней мере, шесть серотипов капсульных антигенов, которые включают K1 – K6 (Laine et al., 1997).
В одном из самых ранних исследований сообщалось, что высокоинкапсулированные штаммы P. gingivalis демонстрируют пониженную аутоагглютинацию, меньшую плотность и более гидрофильны, чем неинкапсулированные штаммы (Van Steenbergen et al., 1987). Согласно Singh et al. (2011), повышенная инкапсуляция также коррелирует с повышенной устойчивостью к фагоцитозу, сывороточной резистентностью и пониженной индукцией хемилюминесценции полиморфно-ядерных лейкоцитов.Кроме того, обнаружено, что капсула участвует в возмущении эпителиальных клеток десны. Исследования Dierickx et al. (2003) выявили, что наличие и тип капсулы оказали значительное влияние на начальную адгезию P. gingivalis к эпителиальным клеткам пародонтального кармана человека. Однако следует отметить, что капсула может взаимодействовать с поверхностным белком, облегчая прикрепление к клеткам-хозяевам. С другой стороны, уровень и механизм коагрегации между P.gingivalis и другой периодопатоген Fusobacterium nucleatum , как было показано, также зависят от капсулы (Rosen and Sela, 2006). Другое исследование Katz et al. (1996) выявили, что вирулентные штаммы P. gingivalis W83 и W50 с более толстыми капсулами вызывают снижение продукции лейкоцитов, чем менее вирулентные штаммы, такие как штамм 376. Это ясно указывает на то, что наблюдаемое различие в штаммах вирулентности является вероятно, из-за разницы в капсульной структуре и адгезионной способности.
Исследования с использованием моделей инфицирования мышей показали, что за счет защиты компонентов микробной поверхности инкапсулированные штаммы P. gingivalis более вирулентны, чем неинкапсулированные штаммы. Неинкапсулированные штаммы обычно вызывают неинвазивные локализованные абсцессы, тогда как инкапсулированные штаммы вызывают инвазивные распространяющиеся флегмонозные инфекции после подкожной инокуляции экспериментальным животным. Неинкапсулированные штаммы также подвергаются усиленному фагоцитозу или быстро убиваются макрофагами и дентритными клетками (Laine et al., 1997). Напротив, с точки зрения эффективности инвазии, капсула P. gingivalis делает ее менее эффективной при проникновении в фибробласты десны по сравнению с некапсулярными штаммами (Irshad et al., 2012). Недавние открытия Brunner et al. (2010) продемонстрировали, что инкапсулированный P. gingivalis способен модулировать ответ хозяина на бактерии за счет снижения синтеза цитокинов интерлейкина-1 (IL-1), IL-6 и IL-8 фибробластами. Помимо своих иммуномодулирующих свойств, на модели абсцесса на мышах было показано, что капсула способствует вирулентности за счет уменьшения фагоцитоза и, таким образом, увеличения выживаемости бактерий в клетках-хозяевах и, в конечном итоге, долгосрочного воспалительного ответа (Singh et al., 2011). Однако влияние окислительного стресса на экспрессию капсулы не принималось во внимание, поскольку эксперименты проводились в анаэробных условиях. Необходимы дальнейшие проверки, чтобы показать более точный вклад капсулы в патогенность. Помимо выживаемости бактерий, капсула также может способствовать увеличению выживаемости за счет снижения бактерицидного эффекта небольшого антимикробного пептида, известного как дефенсины (Igboin et al., 2011). В этом исследовании использовалась модель киллинга Drosophila melanogaster для характеристики реакции хозяина на P.gingivalis инфекция. Следовательно, результаты могут быть не очень значимыми, поскольку Drosophila не является естественным хозяином для P. gingivalis , и взаимодействия хозяин-патоген не могут быть изучены с использованием этого организма.
В последнее десятилетие регуляторные механизмы синтеза капсульной поверхности были объектом пристального внимания. Считается, что механизмы довольно сложны и включают посттранскрипционную регуляцию и экспрессию биосинтетического аппарата из множества локусов.На сегодняшний день у P. gingivalis идентифицировано только два различных регуляторных механизма. One представляет собой тирозинфосфатазу (Ltp1), кодируемую PG1641, которая контролирует экспрессию ряда генов, кодирующих белки, участвующие в синтезе поверхностных полисахаридов. В мутанте с делецией ltp1 экспрессия капсулы К-антигена подавлялась (Maeda et al., 2008). Вторым регуляторным механизмом, который был идентифицирован, является β-субъединица HU белка DNABII (PG0121), которая аналогичным образом вызвала снижение экспрессии локуса синтеза K-антигена у мутанта PG0121 (Priyadarshini et al., 2013; Tjokro et al., 2014). Последнее исследование Bainbridge et al. (2015) продемонстрировали, что молекула антисмысловой РНК, которая кодируется внутри инвертированного повторяющегося элемента из 77 п.н. около 5′-конца генов синтеза капсулы K-антигена, влияет на экспрессию капсульной поверхности вирулентного штамма W83 P. gingivalis . Удаление этого элемента снижает синтез капсулы и изменяет структуру LPS (Bainbridge et al., 2015). Эти основные результаты важны для выяснения регуляторной роли вторичной структуры РНК в модулировании синтеза капсулы К-антигена.Однако неизвестно, является ли антисмысловая РНК подлинной РНК или кодирует сигнальный пептид. Кроме того, неизвестно, могут ли другие регуляторные гены играть роль во взаимодействии с другими белками или ферментами при производстве капсул.
Фимбрии
Фимбрии — это тонкие белковые придатки на поверхности, которые выступают из внешней мембраны бактериальной клетки. Эти структуры длиной 3–25 мкм являются укрытием для большинства штаммов P. gingivalis . Исследование P.gingivalis fimbriae имеет долгую историю, восходящую к 1980-м годам (Handley and Tipler, 1986). Исследования показали, что P. gingivalis экспрессирует две различные фимбрии на своей клеточной поверхности: одна состоит из субъединичного белка (названного FimA или фимбриллин), кодируемого геном fimA (названного длинными или основными фимбриями), а другая субъединица Mfa белок кодируется геном mfa1 (называемым короткими, минорными или фимбриями Mfa1). Несмотря на то, что две фимбрии антигенно различаются и различаются по своему аминокислотному составу, считается, что они способствуют прогрессированию воспалительных реакций пародонта (Amano et al., 2010). Интересно, что основная фимбрия-подобная структура была обнаружена у штамма P. gingivalis , в котором не были обнаружены ни FimA, ни Mfa1 фимбрии. Эти новые фимбрии 53 кДа являются еще одним основным белком внешней мембраны P. gingivalis (Nagano et al., 2015).
В зависимости от штамма белок FimA имеет размер от 40,5 до 49 кДа. Основываясь на аминоконце и последовательностях ДНК, он подразделяется на шесть типов: типы I – V и Ib (Fujiwara et al., 1993; Hajishengallis et al., 2008). Штаммы с типом IV FimA, такие как штаммы W50 и W83, плохо фимбрируются. Штаммы 381, ATCC 33277 и HG565, напротив, представляют собой штаммы типа I с обильно фимбриированными клетками, которые обладают значительной адгезией к тканям хозяина. Сообщалось, что у большинства пародонтальных пациентов были штаммы FimA типа II, за которыми следовали штаммы типа IV (Amano et al., 2004).
Исследования малых фимбрий массой 67 кДа очень ограничены. Клональное разнообразие минорных фимбрий среди штаммов P. gingivalis изучено недостаточно.Подобно белку FimA, отдельные минорные молекулы фимбрий, FimCDE, обнаруживаются в разных штаммах. Исследование Amano et al. (2004) продемонстрировали, что минорные фимбрии стимулировали выработку макрофагами интерлейкина-1α (IL-1α), IL-1β, IL-6 и фактора некроза опухоли-α (TNF-α). Постулируется, что малая фимбрия является причинным фактором резорбции альвеолярной кости в моделях на животных. Это исследование, однако, требует дальнейшей проверки, поскольку клональное разнообразие малых фимбрий неясно, но, вероятно, способствует прогрессированию пародонтита у человека.
Ранние исследования в 1990-х на штаммах P. gingivalis с дефицитом фимбрий выявили важную роль фимбрий в связывании, а также во вторжении в клетки-хозяева (Lee et al., 1992; Sharma et al., 1993). Он также обеспечивает прилипание к широкому спектру субстратов и молекул ротовой полости, включая белки внеклеточного матрикса, эпителиальные и комменсальные бактерии полости рта, такие как стрептококки и Actinomyces viscosus (Amano, 2007). Амано (2010) сообщил, что фимбрии типа II способны прикрепляться к клеточному α 5 β 1 -интегрину, что позволяет бактериям легко поглощаться фагоцитами хозяина и дендритными клетками и вызывает перестройку актинового цитоскелета для облегчения интернализации.Впоследствии это позволяет внутриклеточным бактериям нарушать клеточную функцию хозяина за счет факторов вирулентности (Zenobia and Hajishengallis, 2015; , рисунок ). Сообщалось, что основные фимбрии участвуют в начальной инвазии остеобластов с помощью P. gingivalis , но не являются существенными для последующего ингибирования дифференцировки и минерализации остеобластов (Zhang et al., 2011).
P. gingivalis Манипуляции с входом в дендритные клетки с использованием минорных фимбрий Mfa1 и дополнительных белков. Адгезивные свойства фимбрий позволяют P. gingivalis избегать клеток-хозяев и избегать иммунного надзора. По материалам Зенобии и Хаджишенгаллиса (2015).
Во многих сообщениях утверждается, что остатки FimA в фимбриях связываются с молекулами-мишенями, но сообщается, что минорные компоненты FimCDE критически функционируют как адгезин (Yoshimura et al., 2009). Белок FimA не был существенным для инвазивных способностей везикул внешней мембраны P. gingivalis .Тем не менее, большее количество белковых компонентов, связанных с везикулами, происходящими из фимбриированного штамма, интернализуется в фибробласты десен человека по сравнению с фимбриированным штаммом (Mantri et al., 2015). Кроме того, фимбрия P. gingivalis действуют как важный фактор вирулентности в прогрессировании атеросклероза. Сообщалось, что инфекция P. gingivalis снижает уровень регуляторных Т-клеток (Tregs) у пациентов с атеросклерозом. Во время этого процесса Treg могут играть решающую роль в аутоиммунном ответе.Однако остается неизвестным, связана ли инфекция P. gingivalis с нарушением регуляции Treg во время атеросклероза, и распространенность различных генотипов P. gingivalis FimA во время этого процесса остается неясной (Yang et al., 2014).
Между тем, существуют различные соединения растительного происхождения, используемые для подавления активности P. gingivalis . Два из этих исследований были выполнены Murakami et al. (2015) о противовоспалительной активности кверцетина, ресвератрола и родственных ему соединений, катехина, эпикатехина, орцинола и 4-аллилфенола.Было продемонстрировано, что природные соединения проявляют ингибирующее действие на активность фимбрий P. gingivalis . Однако следует отметить, что необходимы дополнительные исследования различных штаммов P. gingivalis для поддержки вышеупомянутых гипотез, поскольку изменчивость штаммов может иметь различную патогенность.
Липополисахарид (ЛПС)
Липополисахарид (ЛПС) представляет собой относительно большую молекулу размером не менее 10 кДа. Он составляет важный компонент внешней мембраны бактерий (Hamada et al., 1994). В общем, бактериальный LPS состоит из дистального полисахарида (или O-антигена), неповторяющегося «основного» олигосахарида и гидрофобного домена, известного как липид A (или эндотоксин) (Ogawa and Yagi, 2010; , рисунок ). Липид A, самый внутренний компонент, представляет собой биологически активную область LPS, которая может вызывать нарушение регуляции врожденной иммунной системы млекопитающих путем взаимодействия с обоими toll-подобными рецепторами 2 и 4 (Darveau et al., 2004). Он имеет гетерогенные паттерны ацилирования, которые изменяются в зависимости от условий микроокружения и влияют на передачу сигналов иммунной системы хозяина, тем самым способствуя выживанию бактерий в организме хозяина (Al-Qutub et al., 2006).
Схематическая структура липополисахарида (ЛПС) внешней мембраны P. gingivalis . По материалам Ogawa and Yagi (2010).
У грамотрицательных бактерий ЛПС играет важную роль в поддержании клеточной и структурной целостности, а также в контроле проникновения гидрофобных молекул и токсичных химикатов. Фактически, сворачивание и вставка белка внешней мембраны не может происходить в отсутствие LPS (Silhavy et al., 2010).На основании своей биологической активности установлено, что ЛПС является важным патогенным фактором среди многих пародонтопатических бактерий. Ряд исследований сообщил о способности этого компонента внешней мембраны активировать воспалительные реакции хозяина и нарушать процесс ремоделирования костей (Herath et al., 2011; Kato et al., 2014). В клинически здоровом пародонте нормальная воспалительная реакция является фундаментальным компонентом системы защиты хозяина с выработкой IL-1. Считается, что IL-1 играет роль в патогенезе заболеваний пародонта через воспалительные реакции через активацию толл-подобного рецептора 4 (Bartold and Narayanan, 2006; Jain and Darveau, 2010).
Одна из возможных ролей LPS в P. gingivalis заключается в нарушении надзора за врожденным хозяином путем вмешательства в распределение лейкоцитов в непосредственной близости от бактериальной колонизации. Фактически, ЛПС P. gingivalis плохо распознается врожденной системой защиты хозяина по сравнению с ЛПС других грамотрицательных видов (например, Escherichia coli ) (Liu et al., 2008). Помимо этого, была парализована способность эпителиальных клеток десен секретировать хемокин интерлейкин 8 (IL-8), что нарушает активацию нейтрофилов, эозинофилов и базофилов (Yoshimura et al., 1997; Darveau et al., 1998). Это явление, известное как хемокиновый паралич, приводит к устойчивости к окислительному взрыву полиморфноядерными нейтрофилами. В отсутствие эффективной врожденной иммунной защиты хозяина количество пародонтальных бактерий может значительно увеличиться. Рост бактериальной популяции в области десен в сочетании с неспособностью системы защиты хозяина удалить их, согласуется с наблюдаемой этиологией пародонтоза. Помимо индукции синтеза провоспалительных цитокинов, P.gingivalis LPS ингибирует дифференцировку и минерализацию остеобластов в стволовых клетках периодонтальной связки, которые участвуют в регенерации тканей пародонта (Kato et al., 2014).
Кроме того, недавнее исследование на мышах продемонстрировало, что P. gingivalis LPS системно циркулирует более чем у 50% пародонтальных пациентов и, как было установлено, имеет более высокий уровень матриксной металлопротеиназы. Низкий системный LPS запускает воспалительную реакцию в левом желудочке через металлопротеиназу, тем самым вызывая сердечную дисфункцию (DeLeon-Pennell et al., 2013). Кроме того, ЛПС также стимулирует выработку тромбоспондина-1, многофункционального белка внеклеточного матрикса, секретируемого моноцитарными клетками человека. Тромбоспондин-1 стимулирует миграцию макрофагов и модулирует воспалительный ответ хозяина (Gokyu et al., 2014). Воспалительные реакции опосредуются множеством генов. Одним из них является мРНК-связывающий белок ингибитора активатора плазминогена типа I (PAI-1), который, как сообщалось, активируется в воспалительной десне при индуцировании P.gingivalis LPS (Na et al., 2014). Несмотря на то, что PAI-1 играет решающую роль в миграции клеток, необходимы дальнейшие исследования, чтобы понять функцию системы активатора плазминогена в сигнальном пути клетки.
Растущее количество свидетельств показывает, что некоторые природные соединения проявляют ингибирующее действие на ЛПС. Сообщалось, что альфа-мангостин вызывает снижение экспрессии IL-6 и IL-8 в фибробластах десен человека (Yiemwattana and Kaomongkolgit, 2015). Более недавнее открытие Ci et al.(2015) продемонстрировали ингибирующее действие экстрактов проантоцианидина виноградных косточек на ЛПС P. gingivalis , в то время как Derradjia et al. (2015) сообщили о роли альфа-токоферола в противодействии повреждающему эффекту ЛПС за счет снижения воспалительных цитокинов, увеличения бета-дефенсинов, антимикробного пептида и стимулирования роста и миграции фибробластов десны. С другой стороны, торментиновая кислота ингибирует LPS-индуцированный воспалительный ответ в фибробластах десен человека (Jian et al., 2015). Поскольку обнаружено, что мучная кислота обладает противовоспалительным действием, ингибируя выработку IL-6 и IL-8, она может быть возможным терапевтическим агентом при заболеваниях пародонта.
В недавнем исследовании Díaz et al. (2015) было обнаружено, что различия в профиле ЛПС клинических изолятов P. gingivalis влияют на морфологию колоний и устойчивость к полимиксину B. В отличие от здоровых субъектов, изоляты от субъектов пародонта обладали устойчивостью к полимиксину B и демонстрировали низкую способность к агрегации.Эта устойчивость сильно коррелирует с вариациями в профилях ЛПС, так как ЛПС здоровых субъектов не имеет высокомолекулярных антигенных составляющих O и анионного полисахарида (Díaz et al., 2015), тогда как изоляты P. gingivalis от пародонта продуцируют модифицированные липиды. Молекулы. Однако роль других компонентов ЛПС плохо изучена, и участие других факторов вирулентности в реакции на противомикробные соединения не принималось во внимание.
Еще один важный момент, на который стоит обратить внимание, — это экспрессия LPS в различных P.gingivalis , и их роль на различных стадиях инфекции до сих пор остается спорной. Одной из основных причин предположительно могло быть использование различных штаммов P. gingivalis , которые неизбежно плейотропны по отношению к другим патогенным свойствам. Следовательно, основа вариабельности ЛПС у разных штаммов еще не установлена.
Протеазы
Способность большинства штаммов P. gingivalis секретировать многочисленные гидролитические, протеолитические и липолитические ферменты вместе с токсичными метаболитами является одной из характеристик вирулентности, которая позволяет этим бактериям процветать в полости рта.Эти ферменты обычно находятся в непосредственной близости с клетками-хозяевами. В то время как некоторые ферменты находятся в периплазматическом пространстве, другие переносятся из внешней мембраны в пузырьки внешней мембраны во время роста. Один из типов ферментов, протеазы, по-видимому, сильно влияет на прогрессирование заболеваний пародонта. Среди этих протеаз — трипсин-, тиол-, казеинолитические протеиназы и пептидазы (Travis et al., 1997; Curtis et al., 2001).
Обычно существует два различных семейства протеаз, продуцируемых P.gingivalis . Одно из них — это семейство цистеиновых протеиназ, также известное как «трипсиноподобный» фермент, а другое — сериновая протеиназа (Bostanci and Belibasakis, 2012). «Трипсиноподобные» ферменты расщепляют полипептиды на С-конце после остатка аргинина или лизина. Эти протеиназы, обычно известные как гингипаины, а именно гингипаин R и K, расщепляются после аргинина и лизина соответственно. В совокупности они обеспечивают 85% внеклеточной протеолитической активности P. gingivalis в очаге инфекции (de Diego et al., 2014). Существует два типа гингипаина R, а именно RgpA и RgpB, и один тип гингипаина K, Kgp. Гингипаин R разрушает компоненты внеклеточного матрикса, включая интегрин-фибронектин-связывающий, цитокин, иммуноглобулин и факторы комплемента (Curtis et al., 2001). Это также жизненно важно для обработки и созревания основных фимбрий (FimA) (Kristoffersen et al., 2015). И гингипаин R, и K были выделены из многих штаммов P. gingivalis , выращенных в различных условиях.
Имеются убедительные доказательства того, что протеазы P. gingivalis непосредственно участвуют в колонизации пародонтального кармана, что приводит к разрушению поддерживающей ткани пародонта (Andrian et al., 2004; Dubin et al., 2013). Кроме того, протеазы также придают микроорганизмам высокую устойчивость к защитным механизмам хозяина. Обширные исследования за последнее десятилетие показали, что протеазы P. gingivalis участвуют в деградации белков внеклеточного матрикса, таких как коллаген, активации металлопротеиназ матрикса хозяина, инактивации ингибиторов протеиназ плазмы, расщеплении рецепторов на поверхности клетки и нарушении регуляции воспалительные (Potempa et al., 2000; Имамура и др., 2003). Они также являются важными дополнительными агентами для роста T. forsythia и A. actinomycetemcomitans в смешанной биопленке с P. gingivalis (Bao et al., 2014; Haraguchi et al., 2014).
Было обнаружено, что гингипаин разрушает фибриноген и белки гема хозяина, которые способствуют ингибированию свертывания крови и увеличивают кровотечение, тем самым повышая доступность гемина для роста бактерий (Sroka et al., 2001).Следовательно, не может быть удивительным обнаружение высокой пролиферации P. gingivalis в пародонтальных карманах, в которых много эритроцитов. Гингипаины также считаются важными по своей способности расщеплять антибактериальные пептиды, такие как нейтрофильные α-дефенсины, факторы комплемента, такие как C3 и C4, рецепторы Т-клеток, такие как CD4 и CD8 (Hajishengallis et al., 2013; Bao et al. др., 2014). Они также снижают экспрессию рецепторов врожденного иммунитета CD14, что приводит к гипореактивности макрофагов к бактериальной инфекции.Однако вопрос о том, связана ли снижение экспрессии CD14 с пародонтитом, вызванным P. gingivalis , требует дальнейшего выяснения. В недавней работе Maekawa et al. (2014), P. gingivalis и его гингипаины, активно манипулируют молекулами хозяина, например, препятствуя перекрестному обмену сигналами между рецептором C5a и толл-подобным рецептором, чтобы предотвратить бактериальный клиренс. Исследования in vitro продемонстрировали, что гингипаины участвуют в регуляции медиаторов воспаления из различных клеток-хозяев, включая IL-1α, IL-1β, IL-18 (Hamedi et al., 2009), рецептор, активируемый протеазой (PAR) -2 (Belibasakis et al., 2010), или растворимый запускающий рецептор, экспрессируемый на миелоидных клетках (sTREM) -1 (Bostanci et al., 2013). Тем не менее, до такой степени нет конкретных доказательств одновременного действия гингипаинов на эти медиаторы воспаления при прогрессировании пародонтита.
Райн, антрахинон из корней ревеня, проявляет антибактериальный синергетический эффект с другими полифенолами. Он вызывает подавление двух генов протеаз, rgpA и kgp, которые связаны с инактивацией защитных механизмов хозяина и разрушением тканей (Azelmat et al., 2015). С другой стороны, теафлавины, основные полифенолы в черном чае, заметно ингибируют протеиназную активность гингипаинов P. gingivalis в зависимости от дозы (Kong et al., 2015). Синтетический двойной ингибитор протеазы, названный KYT-41, был синтезирован, и было обнаружено, что он обладает сильной антибактериальной активностью против P. gingivalis . Этот двойной ингибитор протеаз Rgp и Kgp проявляет противовоспалительную активность, поэтому считается многообещающим средством для профилактики и лечения гингивита (Kataoka et al., 2014).
Белки внешней мембраны
Клеточная оболочка грамотрицательных бактерий, таких как Porphyromonas sp. состоит из двух клеточных мембран, внешней мембраны (OM) и внутренней мембраны (IM). Оба слоя мембран имеют разный состав и структуру. Они разделены периплазмой, содержащей слой пептидогликана. В то время как IM представляет собой бислой фосфолипидов с многочисленными интегральными белками IM (Bos et al., 2007), OM представляет собой асимметричный бислой, который состоит из фосфолипидов и липополисахаридов во внутреннем и внешнем листках, соответственно.Мембрана бактериальной клетки играет роль селективного барьера, обеспечивающего защиту и позволяющего перемещаться различным веществам через пориновые белки ОМ (Nikaido, 2003). Белки OM обычно делятся на две категории: липопротеины OM, которые прикреплены к OM с помощью N-концевого липидного хвоста, и другие интегральные белки OM, которые содержат области, пронизывающие мембраны (Bos and Tommassen, 2004).
ОМ участвует в большинстве специфических процессов распознавания, так как это наиболее уязвимая область бактериальной клетки.Поскольку в области OM существует относительно немного основных белков, ожидается, что эти белки будут важными антигенами для хозяина. Постулируется, что образование и поддержание пародонтальных биопленок связано с взаимодействием между пародонтальной микрофлорой, которое опосредуется белками OM (Bos et al., 2007). Имеются данные о том, что Т-хелперные клетки пациентов с агрессивным пародонтитом, активированные белками P. gingivalis OM, продуцируют более высокие уровни провоспалительных цитокинов, таких как IL-1β и IL-6, по сравнению со здоровыми контрольными людьми (Gonzales et al., 2014).
Анализ белков, экстрагированных из ОМ с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE), показал, что ОМ состоит из разнообразного набора белков размером от 20 до более 100 кДа. Наиболее часто встречающимися белками OM являются порины и OmpA-подобные белки (Bos et al., 2007). Однако до недавнего времени исследования основных белков OM в P. gingivalis оставались недостаточными из-за гидрофобной природы белков. Было сделано несколько попыток охарактеризовать белки OM с использованием различных методов солюбилизации (Yoshimura et al., 2009).
Одно из самых ранних исследований выполнено Yoshimura et al. (1989), в котором был успешно очищен главный ОМ-белок массой 75 кДа, существующий в виде высокомолекулярного олигомера. Этот белок был продемонстрирован Watanabe et al. (1992), чтобы стимулировать активацию поликлональных B-клеток и продукцию IL-1 из перитонеальных макрофагов мыши.
С другой стороны, Saito et al. (1997) сообщили, что ОМ-белок массой 40 кДа из P. gingivalis является важным фактором агрегации на поверхности клетки.В этом исследовании антитело против белка ингибировало активность агрегации клеток P. gingivalis по отношению к A. viscosus , которая является одним из пионеров колонизации поверхности зубов. Этот ОМ-белок массой 40 кДа обнаружен во многих штаммах P. gingivalis , располагаясь как на поверхности клетки, так и во внеклеточных пузырьках. Чрескожная иммунизация мышей ОМ-белком 40 кДа вызвала повышение уровня антител IgG, которые ингибировали коагрегацию P.gingivalis пузырьков (Maeba et al., 2005). В последние годы в исследованиях на животных моделях Zhang et al. (2009) и Liu et al. (2010) было продемонстрировано, что вакцинация мышей ОМ-белком 40 кДа из P. gingivalis вызывает значительное снижение потери альвеолярной кости.
ОМ-белок массой 40 кДа также является гемин-связывающим белком (Shibata et al., 2003). Между тем, назальная иммунизация с использованием белка OM 40 кДа плюс холерный токсин вызывает защитный иммунный ответ против P. gingivalis как у молодых, так и у старых мышей, помимо предотвращения атеросклероза (Koizumi et al., 2008; Cai et al., 2013). В совокупности результаты предполагают, что назальная доставка белка OM может быть потенциальной стратегией вакцины для обеспечения защитного иммунитета человека и, следовательно, профилактики пародонтита.
Кроме того, сравнивались профили белков OM P. gingivalis ATCC 33277 и W83, и было обнаружено, что оба штамма обладают большинством белков OM, таких как RagA, RagB и OmpA-подобных белков, с аналогичным характером распределения ( Имаи и др., 2005). Эти данные, полученные с помощью иммуноблоттинга, позволяют предположить, что эти белки OM представляют собой поверхностные иммунореактивные антигены, но перекрестно реагируют с другими P.gingivalis , должны быть приняты во внимание штаммы.
Согласно Chen et al. (2011) было обнаружено, что белок ОМ, LptO (PG0027) необходим для деацилирования O LPS P. gingivalis , и постулируется, что такое структурное образование необходимо для обеспечения прикрепления к клеткам-хозяевам. Он также играет важную роль в секреции гингипаина на поверхность клеток. С помощью синего нативного PAGE-анализа LptO был обнаружен в составе комплексов до семи различных размеров, и он взаимодействовал с другим белковым комплексом, PG0026, при секреции белков С-концевого домена (Glew et al., 2014; Сайки и Кониши, 2014). Кроме того, было обнаружено, что новый белок OM, названный PG534, играет важную роль в производстве активных гингипаинов (Saiki and Konishi, 2010). Активность гингипаинов R (RgpA и RgpB) и гингипаина K (Kgp) в P. gingivalis с дефектным белком PG534 была снижена по сравнению с его штаммом дикого типа.
Также проводятся исследования по ослаблению действия белков ОМ P. gingivalis . Например, исследования природных экстрактов растений, таких как полифенолы Myrothamnus flabellifolia , показали, что они снижают уровень P.gingivalis адгезия и инвазия до примерно 50% за счет взаимодействия с бактериальными белками ОМ. Такой антиадгезивный эффект также сопровождается цитопротекторным действием, связанным с секрецией цитокинов (Löhr et al., 2011). Однако следует отметить, что этот растительный экстракт был протестирован только на белках OM, но не на других компонентах вирулентности P. gingivalis .
Заключение
В совокупности P. gingivalis является основным этиологическим фактором развития хронического пародонтита.Было обнаружено, что этот вторичный колонизатор экспрессирует множество факторов вирулентности, участвующих в колонизации поддесневого налета и модуляции иммунных ответов клеток-хозяев. Чтобы увеличить выживаемость в организме хозяина, P. gingivalis способен локально вторгаться в ткань периондонта, тем самым избегая иммунного надзора, сохраняя при этом свою жизнеспособность. Каждый фактор вирулентности играет важную роль в препятствовании клеточно-опосредованному иммунному ответу хозяина. Тем не менее, несмотря на убедительные данные, представленные в этом исследовании, следует предупредить, что в реальной ситуации in vivo бактерии экспрессируют целый набор факторов вирулентности, которые могут взаимодействовать и стимулировать клетки-хозяева иначе, чем бактерии. единичный фактор вирулентности.Кроме того, заболевания пародонта редко возникают в результате действия отдельных бактерий. Следовательно, P. gingivalis , вероятно, будет работать с другой микробиотой полости рта, чтобы процветать в тяжелых воспалительных условиях в пародонтальном кармане.
На сегодняшний день было проведено множество исследований для выяснения механизма вирулентности соединений, секретируемых P. gingivalis , и клеточного взаимодействия с хозяином. Лучшее понимание взаимодействия между пародонтальными бактериями и клетками-хозяевами на молекулярном и клеточном уровне может в конечном итоге иметь отношение к общему благополучию хозяина.В последние годы использование натуральных соединений привлекло больше внимания для ослабления действия P. gingivalis . Натуральные продукты растительного происхождения широко используются в качестве терапевтических средств для регулирования взаимодействий между микроорганизмами. Одним из привлекательных терапевтических свойств является то, что биологически активные соединения растений безопасны и не должны вызывать токсичность по отношению к клеткам человека. Тем не менее, всесторонние исследования токсичности этих соединений по-прежнему считаются необходимыми.
Благодаря огромному прогрессу в биомедицинских исследованиях мы надеемся в конечном итоге выяснить возможный уникальный механизм действия P.gingivalis и его детерминанты вирулентности. Исследования в этой области помогут в разработке эффективных методов лечения бактериальной деструкции соединительной ткани. Эти терапевтические подходы могут быть важны в борьбе с хроническими инфекциями P. gingivalis , предотвращая рост и колонизацию P. gingivalis .
Вклад авторов
KH проанализировал литературу и написал статью, KS и KC отредактировали и одобрили рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантами на высокоэффективные исследования Университета Малайи (UM C / 625/1 / HIR / MOHE / CHAN / 01, A-000001-50001 и UM C / 625/1 / HIR / MOHE / CHAN / 14/1, H-50001-A000027) присужден KC.
Ссылки
- Aas J.А., Пастер Б. Дж., Стокс Л. Н., Олсен И., Дьюхерст Ф. Э. (2005). Определение нормальной бактериальной флоры полости рта. J. Clin. Microbiol. 43 год 5721–5732. 10.1128 / JCM.43.11.5721-5732.2005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Али Р. В., Велческу К., Дживанеску М. К., Лофтус Б., Скауг Н. (1996). Распространенность 6 предполагаемых патогенов пародонта в образцах поддесневого налета от взрослых пациентов с пародонтитом в Румынии. J. Clin. Пародонтол. 23 133–139.10.1111 / j.1600-051X.1996.tb00546.x [PubMed] [CrossRef] [Google Scholar]
- Али Т., Абидин К. З. (2012). Связь заболеваний пародонта с недоношенными новорожденными с низкой массой тела в выбранной популяции — проспективное исследование. Общественная вмятина. Здоровье 29 100–105. [PubMed] [Google Scholar]
- Аль-Кутуб М. Н., Брахам П. Х., Карими-Насер Л. М., Лю Х., Дженко К. А., Дарво Р. П. (2006). Гемин-зависимая модуляция структуры липида А липополисахарида Porphyromonas gingivalis . Заражение. Иммун. 74 4474–4485. 10.1128 / IAI.01924-05 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2007). Нарушение эпителиального барьера и нарушение клеточной функции Porphyromonas gingivalis . Фронт. Biosci. 12: 3965–3974. 10.2741 / 2363 [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2010). Бактериальные адгезии к компонентам хозяина при пародонтите. Пародонтология 2000 г. 12–37. 10.1111 / j.1600-0757.2009.00307.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Накагава И., Окахаши Н., Хамада Н. (2004). Вариации фимбрий Porphyromonas gingivalis в зависимости от микробного патогенеза. J. Пародонтология. Res. 39 136–142. 10.1111 / j.1600-0765.2004.00719.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Такеучи Х., Фурута Н. (2010). Везикулы наружной мембраны действуют как наступательное оружие во взаимодействиях паразит-хозяин. Microbes Infect. 12 791–798.10.1016 / j.micinf.2010.05.008 [PubMed] [CrossRef] [Google Scholar]
- Андриан Э., Гренье Д., Руабиа М. (2004). Модели проникновения и разрушения тканей in vitro с помощью Porphyromonas gingivalis . Заражение. Иммун. 72 4689–4698. 10.1128 / IAI.72.8.4689-4698.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Азельмат Дж., Ларенте Дж. Ф., Гренье Д. (2015). Антрахиноновый реин проявляет синергетическую антибактериальную активность в сочетании с метронидазолом или природными соединениями и снижает экспрессию гена вирулентности в Porphyromonas gingivalis . Arch. Oral Biol. 60 342–346. 10.1016 / j.archoralbio.2014.11.006 [PubMed] [CrossRef] [Google Scholar]
- Бэк К. Дж., Джи С., Ким И. С., Чой Ю. (2015). Связь инвазионной способности Porphyromonas gingivalis с тяжестью пародонтита. Вирулентность 6 274–281. 10.1080 / 21505594.2014.1000764 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бейнбридж Б. В., Хирано Т., Гришабер Н., Дэйви М. Э. (2015). Удаление инвертированного повторяющегося элемента из 77 пар оснований изменяет синтез поверхностных полисахаридов в Porphyromonas gingivalis . J. Bacteriol. 197 1208–1220. 10.1128 / JB.02589-14 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bao K., Belibasakis GN, Thurnheer T., Aduse-Opoku J., Curtis MA, Bostanci N. (2014) . Роль Porphyromonas gingivalis gingipains в формировании многовидовых биопленок. BMC Microbiol. 14: 258 10.1186 / s12866-014-0258-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бартольд П. М., Нараянан А. С. (2006). Молекулярная и клеточная биология здоровых и больных тканей пародонта. Пародонтология 2000 г. 29–49. 10.1111 / j.1600-0757.2005.00140.x [PubMed] [CrossRef] [Google Scholar]
- Бек Дж., Гарсия Р., Хейсс Г., Воконас П. С., Оффенбахер С. (1996). Заболевания пародонта и сердечно-сосудистые заболевания. J. Periodontol. 67 1123–1137. 10.1902 / jop.1996.67.10.1123 [PubMed] [CrossRef] [Google Scholar]
- Белибасакис Г. Н., Бостанси Н., Редди Д. (2010). Регулирование экспрессии активируемого протеазой рецептора-2 в фибробластах десен и Т-клетках Jurkat с помощью Porphyromonas gingivalis . Cell Biol. Int. 34
287–292. 10.1042 / CBI200
[PubMed] [CrossRef] [Google Scholar]
- Боде К., Чандад Ф., Гренье Д. (2006). [Патогенный потенциал Porphyromonas gingivalis, Treponema denticola и Tannerella forsythia , красного бактериального комплекса, связанного с пародонтитом]. Патол.-биол. 55 154–162. 10.1016 / j.patbio.2006.07.045 [PubMed] [CrossRef] [Google Scholar]
- Бос М. П., Роберт В., Томмассен Дж. (2007). Биогенез внешней мембраны грамотрицательных бактерий. Annu. Rev. Microbiol. 61 191–214. 10.1146 / annurev.micro.61.080706.0 [PubMed] [CrossRef] [Google Scholar]
- Bos M. P., Tommassen J. (2004). Биогенез внешней мембраны грамотрицательных бактерий. Curr. Opin. Microbiol. 7 610–616. 10.1016 / j.mib.2004.10.011 [PubMed] [CrossRef] [Google Scholar]
- Бостанци Н., Белибасакис Г. Н. (2012). Porphyromonas gingivalis : инвазивный и ускользающий оппортунистический оральный патоген. FEMS Microbiol.Lett. 333 1–9. 10.1111 / j.1574-6968.2012.02579.x [PubMed] [CrossRef] [Google Scholar]
- Бостанси Н., Турнхеер Т., Адусе-Опоку Дж., Кертис М. А., Зинкернагель А. С., Белибасакис Г. Н. (2013). Porphyromonas gingivalis регулирует TREM-1 в полиморфно-ядерных нейтрофилах человека через гингипаины. PLoS ONE 8: e75784 10.1371 / journal.pone.0075784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бруннер Дж., Шерес Н., Эль Идрисси Н. Б., Дэн Д.М., Лайне М. Л., ван Винкельхофф А. Дж. И др. (2010). Капсула Porphyromonas gingivalis снижает иммунный ответ фибробластов десен человека. BMC Microbiol. 10: 5 10.1186 / 1471-2180-10-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Cai Y., Kurita-Ochiai T., Kobayashi R., Hashizume T., Yamamoto M. (2013) . Назальная иммунизация белком внешней мембраны 40 кДа Porphyromonas gingivalis плюс холерный токсин индуцирует защитный иммунитет у старых мышей. J. Oral Sci. 55 107–114. 10.2334 / josnusd.55.107 [PubMed] [CrossRef] [Google Scholar]
- Касарин Р. К., Дель Пелосо Рибейро Э., Мариано Ф. С., Носити Ф. Х., младший, Казати М. З., Гонсалвес Р. Б. (2010). Уровни Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis , воспалительных цитокинов и видоспецифического иммуноглобулина G при генерализованном агрессивном и хроническом пародонтите. J. Periodont. Res. 45 635–642. 10.1111 / j.1600-0765.2010.01278.x [PubMed] [CrossRef] [Google Scholar]
- Чен Ю., Пэн Б., Ян К., Глю М. Д., Вейт П. Д., Кросс К. Дж. и др. (2011). Белок внешней мембраны LptO необходим для O-деацилирования LPS и координированной секреции и прикрепления белков A-LPS и CTD в Porphyromonas gingivalis . Мол. Microbiol. 79 1380–1401. 10.1111 / j.1365-2958.2010.07530.x [PubMed] [CrossRef] [Google Scholar]
- Ci X., Chen L., Ou X. (2015). Экстракты проантоцианидинов виноградных косточек ингибируют липополисахарид Porphyromonas gingivalis . Shanghai J. Stomatol. 24 433–436. [PubMed] [Google Scholar]
- Curtis M., Aduse-Opoku J., Rangarajan M. (2001). Цистеиновые протеазы Porphyromonas gingivalis . Crit. Rev. Oral Biol. Med. 12 192–216. 10.1177 / 10454411010120030101 [PubMed] [CrossRef] [Google Scholar]
- Дарво Р. П., Белтон К. М., Райф Р. А., Ламонт Р. Дж. (1998). Местный хемокиновый паралич, новый патогенетический механизм Porphyromonas gingivalis . Заражение.Иммун. 66 1660–1665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Дарво Р. П., Фам Т.-Т. Т., Лемли К., Райфе Р. А., Бейнбридж Б. В., Коутс С. Р. и др. (2004). Porphyromonas gingivalis липополисахарид содержит несколько видов липидов A, которые функционально взаимодействуют с обоими toll-подобными рецепторами 2 и 4. Заражение. Иммун. 72 5041–5051. 10.1128 / IAI.72.9.5041-5051.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Датта Х. К., Нг В. Ф., Уокер Дж. А., Так С. П., Варанаси С. С. (2008). Клеточная биология костного метаболизма. J. Clin. Патол. 61 577–587. 10.1136 / jcp.2007.048868 [PubMed] [CrossRef] [Google Scholar]
- de Diego I., Veillard F., Sztukowska M. N., Guevara T., Potempa B., Pomowski A., et al. (2014). Структура и механизм цистеинпептидазы Gingipain K (Kgp), основного фактора вирулентности Porphyromonas gingivalis при пародонтите. J. Biol. Chem. 289 32291–32302.10.1074 / jbc.M114.602052 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- ДеЛеон-Пеннелл К. Ю., де Кастро Брас Л. Э., Линдси М. Л. (2013). Циркулирующий липополисахарид Porphyromonas gingivalis сбрасывает сердечный гомеостаз у мышей посредством механизма, зависимого от матриксной металлопротеиназы-9. Physiol. Репутация 1: e00079 10.1002 / phy2.79 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дерраджиа А., Аланази Х., Пак Х. Дж., Джериби Р., Семлали А., Руабия М. (2015). α-токоферол снижает уровень интерлейкинов-1β и -6 и увеличивает секрецию β-дефенсинов-1 и -2 человека в фибробластах десен человека, стимулированных липополисахаридом Porphyromonas gingivalis . J. Periodontal Res. 10.1111 / jre.12308 [Epub перед печатью]. [PubMed] [CrossRef] [Google Scholar]
- Диас Л., Хоар А., Сото К., Бугеньо И., Сильва Н., Дутзан Н. и др. (2015). Изменения липополисахаридного профиля клинических изолятов Porphyromonas gingivalis коррелируют с изменениями морфологии колоний и устойчивости к полимиксину B. Анаэроб 33 25–32. 10.1016 / j.anaerobe.2015.01.009 [PubMed] [CrossRef] [Google Scholar]
- Dierickx K., Pauwels M., Laine M. L., Van Eldere J., Cassiman J. J., van Winkelhoff A. J. и др. (2003). Адгезия серотипов Porphyromonas gingivalis к эпителию кармана. J. Periodontol. 74 844–848. 10.1902 / jop.2003.74.6.844 [PubMed] [CrossRef] [Google Scholar]
- Дорн Б. Р., Беркс Дж. Н., Зейферт К. Н., Прогульске-Фокс А. (2000). Инвазия эндотелиальных и эпителиальных клеток штаммом Porphyromonas gingivalis . FEMS Microbiol. Lett. 187 139–144. 10.1111 / j.1574-6968.2000.tb09150.x [PubMed] [CrossRef] [Google Scholar]
- Dubin G., Koziel J., Pyrc K., Wladyka B., Potempa J. (2013). Бактериальные протеазы в заболевании — роль во внутриклеточном выживании, уклонении от свертывания / фибринолиза, врожденных защитных сил, токсикозов и вирусных инфекций. Curr. Pharm. Des. 19 1090–1113. 10.2174 / 13816128113111 [PubMed] [CrossRef] [Google Scholar]
- Элоэ-Фадрош Э. А., Раско Д. А. (2013).Микробиом человека: от симбиоза к патогенезу. Annu. Rev. Med. 64 145–163. 10.1146 / annurev-med-010312-133513 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Friedewald V. E., Kornman K. S., Beck J. D., Genco R., Goldfine A., Libby P., et al. (2009). Американский кардиологический журнал и консенсус редакторов журнала пародонтологии: пародонтит и атеросклеротическое сердечно-сосудистое заболевание. Am. J. Cardiol. 104 59–68. 10.1016 / j.amjcard.2009.05.002 [PubMed] [CrossRef] [Google Scholar]
- Fujiwara T., Morishima S., Takahashi I., Hamada S. (1993). Молекулярное клонирование и секвенирование гена фимбрилина штаммов Porphyromonas gingivalis и характеристика рекомбинантных белков. Biochem. Биофиз. Res. Commun. 197 241–247. 10.1006 / bbrc.1993.2467 [PubMed] [CrossRef] [Google Scholar]
- Дженко Р. Дж., Боргнакке В. С. (2013). Факторы риска заболеваний пародонта. Пародонтология 2000 г. 59–94.10.1111 / j.1600-0757.2012.00457.x [PubMed] [CrossRef] [Google Scholar]
- Glew M. D., Veith P. D., Chen D., Seers C. A., Chen Y.-Y., Reynolds E. C. (2014). Голубой нативный ПААГ-анализ комплексов мембранных белков в Porphyromonas gingivalis . J. Proteomics 110 72–92. 10.1016 / j.jprot.2014.07.033 [PubMed] [CrossRef] [Google Scholar]
- Гокю М., Кобаяши Х., Нанбара Х., Судо Т., Икеда Й., Суда Т. и др. (2014). Продукция тромбоспондина-1 усиливается липополисахаридом Porphyromonas gingivalis в клетках THP-1. PLoS ONE 9: e115107 10.1371 / journal.pone.0115107 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzales J., Groeger S., Johansson A., Meyle J. (2014). Т-хелперы от пациентов с агрессивным пародонтитом производят более высокие уровни интерлейкина-1 бета и интерлейкина-6 во взаимодействии с Porphyromonas gingivalis . Clin. Устное расследование. 18 1835–1843 гг. 10.1007 / s00784-013-1162-5 [PubMed] [CrossRef] [Google Scholar]
- Haffajee A. D., Сокранский С.С. (1994). Микробные этиологические агенты деструктивных заболеваний пародонта. Пародонтология 2000 г. 78–111. 10.1111 / j.1600-0757.1994.tb00020.x [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Абэ Т., Маэкава Т., Хаджишенгаллис Э., Ламбрис Дж. Д. (2013). Роль комплемента в гомеостазе пародонта микробами-хозяевами. Семин. Иммунол. (Эльзевьер) 25 65–72. 10.1016 / j.smim.2013.04.004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Дарво Р. П., Кертис М. А. (2012). Гипотеза краеугольного камня. Nat. Rev. Microbiol. 10 717–725. 10.1038 / nrmicro2873 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Ламонт Р. Дж. (2014). Во все тяжкие: манипулирование реакцией хозяина с помощью Porphyromonas gingivalis . Eur. J. Immunol. 44 год 328–338. 10.1002 / eji.201344202 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Wang M., Liang S., Триантафилу М., Триантафилу К. (2008). Патогенетическая индукция перекрестных помех CXCR4 / TLR2 нарушает защитную функцию хозяина. Proc. Natl. Акад. Sci. США 105 13532–13537. 10.1073 / pnas.0803852105 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хамада Н., Ватанабе К., Сасакава К., Йошикава М., Йошимура Ф., Умемото Т. (1994). Конструирование и характеристика мутанта fimA Porphyromonas gingivalis . Заражение. Иммун. 62 1696–1704. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hamedi M., Белибасакис Г., Кручли А., Рангараджан М., Кертис М., Бостанси Н. (2009). Porphyromonas gingivalis Супернатанты культур по-разному регулируют интерлейкин-1β и интерлейкин-18 в моноцитарных клетках человека. Цитокин 45 99–104. 10.1016 / j.cyto.2008.11.005 [PubMed] [CrossRef] [Google Scholar]
- Хэндли П. С., Типлер Л. С. (1986). Исследование поверхностных структур и гидрофобности оральных и неоральных видов бактерий рода Bacteroides под электронным микроскопом. Arch. Oral Biol. 31 год 325–335. 10.1016 / 0003-9969 (86) -6 [PubMed] [CrossRef] [Google Scholar]
- Харагути А., Миура М., Фудзисе О., Хамачи Т., Нисимура Ф. (2014). Porphyromonas gingivalis гингипаин участвует в отслоении и агрегации биопленки Aggregatibacter actinomycetemcomitans . Мол. Oral Microbiol. 29 131–143. 10.1111 / omi.12051 [PubMed] [CrossRef] [Google Scholar]
- Хаяси С., Ямада Х., Фукуи М., Ито Х.-О., Сата М. (2015). Корреляция между артериосклерозом и состоянием пародонта, оцениваемая по уровням лактоферрина и α1-антитрипсина в десневой щелевой жидкости. Внутр. Сердце J. 56 639–643. 10.1536 / ihj.15-218 [PubMed] [CrossRef] [Google Scholar]
- Херат Т. Д. К., Ван Й., Сеневиратн К. Дж., Дарво Р. П., Ван С. Й., Джин Л. Дж. (2011). Гетерогенный LPS Porphyromonas gingivalis по-разному модулирует врожденный иммунный ответ десны человека. BMC Proc. 5:86 10.1186 / 1753-6561-5-s1-p86 [CrossRef] [Google Scholar]
- Herzberg M. C., Meyer M. W. (1996). Влияние флоры полости рта на тромбоциты: возможные последствия при сердечно-сосудистых заболеваниях. J. Periodontol. 67 1138–1142. 10.1902 / jop.1996.67.10s.1138 [PubMed] [CrossRef] [Google Scholar]
- Холт С. К., Кесавалу Л., Уокер С., Дженко К. А. (1999). Факторы вирулентности Porphyromonas gingivalis . Пародонтология 2000 г. 168–238. 10.1111 / j.1600-0757.1999.tb00162.x [PubMed] [CrossRef] [Google Scholar]
- Игбоин К. О., Тордофф К. П., Мешбергер М. Л., Гриффен А. Л., Лейс Э. Дж. (2011). Porphyromonas gingivalis -хостовые взаимодействия в модели Drosophila melanogaster . Заражение. Иммун. 79 449–458. 10.1128 / IAI.00785-10 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Имаи М., Мураками Ю., Нагано К., Накамура Х., Йошимура Ф. (2005). Основные белки внешней мембраны из Porphyromonas gingivalis : изменение штамма, распределение и клиническое значение при перирадикулярных поражениях. Eur. J. Oral Sci. 113 391–399. 10.1111 / j.1600-0722.2005.00235.x [PubMed] [CrossRef] [Google Scholar]
- Имамура Т., Трэвис Дж., Потемпа Дж. (2003). Двухфазная вирулентная активность гингипаинов: активация и инактивация белков хозяина. Curr. Protein Pept. Sci. 4
443–450. 10.2174 / 138
33487027 [PubMed] [CrossRef] [Google Scholar]
- Иршад М., ван дер Рейден В. А., Крилаард В., Лейн М. Л. (2012). Инвазия и выживаемость Porphyromonas gingivalis in vitro в фибробластах десен; роль капсулы. Arch. Иммунол. Ther. Exp. 60 469–476. 10.1007 / s00005-012-0196-8 [PubMed] [CrossRef] [Google Scholar]
- Джейн С., Дарво Р. П. (2010). Вклад липополисахарида Porphyromonas gingivalis в пародонтит. Пародонтология 2000 г. 53–70. 10.1111 / j.1600-0757.2009.00333.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дженкинсон Х. Ф., Ламонт Р. Дж. (2006). «Микробная экология полости рта», в Микробиология и иммунология полости рта редакторы Ламонт Р.Дж., Берн Р. А., Ланц М. С., Леблан Д. Дж. (Вашингтон, округ Колумбия: ASM Press;). [Google Scholar]
- Jian C.-X., Li M.-Z., Zheng W.-Y., He Y., Ren Y., Wu Z.-M., et al. (2015). Торментиновая кислота подавляет LPS-индуцированный воспалительный ответ в фибробластах десен человека посредством ингибирования TLR4-опосредованного сигнального пути NF-κB и MAPKs. Arch. Oral Biol. 60 1327–1332. 10.1016 / j.archoralbio.2015.05.005 [PubMed] [CrossRef] [Google Scholar]
- Катаока С., Баба А., Суда Ю., Такий Р., Хашимото М., Кавакубо Т. и др. (2014). Новый мощный двойной ингибитор аргингипаинов и лизингипаинов в качестве многообещающего средства для лечения заболеваний пародонта. FASEB J. 28 год 3564–3578. 10.1096 / fj.14-252130 [PubMed] [CrossRef] [Google Scholar]
- Като Х., Тагучи Ю., Томинага К., Умеда М., Танака А. (2014). Porphyromonas gingivalis LPS подавляет дифференцировку остеобластов и способствует выработке провоспалительных цитокинов в стволовых клетках пародонтальной связки человека. Arch. Oral Biol. 59 167–175. 10.1016 / j.archoralbio.2013.11.008 [PubMed] [CrossRef] [Google Scholar]
- Кац Дж., Уорд Д., Михалек С. (1996). Влияние ответов хозяина на патогенность штаммов Porphyromonas gingivalis . Oral Microbiol. Иммунол. 11 309–318. 10.1111 / j.1399-302X.1996.tb00187.x [PubMed] [CrossRef] [Google Scholar]
- Коидзуми Ю., Курита-Очиаи Т., Огучи С., Ямамото М. (2008). Назальная иммунизация белком внешней мембраны Porphyromonas gingivalis снижает количество P.gingivalis -индуцированный атеросклероз и воспаление у мышей со спонтанной гиперлипидемией. Заражение. Иммун. 76 2958–2965. 10.1128 / IAI.01572-07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Komatsu T. (2014). «Окислительный стресс и заболевания пародонта при синдроме Дауна», в Исследования заболеваний пародонта редакторы Экуни Д., Баттино М., Томофуджи Т., Путнинс Э. Э. (Берлин: Springer;) 211–223. [Google Scholar]
- Kong L., Qi X., Huang S., Chen S., Ву Ю., Чжао Л. (2015). Теафлавины подавляют патогенные свойства P. gingivalis и продукцию ММП в P. gingivalis -стимулированных фибробластах десен человека. Arch. Oral Biol. 60 12–22. 10.1016 / j.archoralbio.2014.08.019 [PubMed] [CrossRef] [Google Scholar]
- Кристофферсен А. К., Солли С. Дж., Нгуен Т. Д., Энерсен М. (2015). Ассоциация генотипа гингипаина rgpB с генотипом основных фимбрий (fimA) в клинических изолятах пародонтального патогена Porphyromonas gingivalis . J. Oral Microbiol. 7: 29124 10.3402 / jom.v7.29124 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kuramitsu H. K., Qi M., Kang I.-C., Chen W. (2001). Роль пародонтальных бактерий в сердечно-сосудистых заболеваниях. Ann. Пародонтол. 6 41–47. 10.1902 / annals.2001.6.1.41 [PubMed] [CrossRef] [Google Scholar]
- Лейн М. Л., Аппельмелк Б. Дж., Ван Винкельхофф А. Дж. (1997). Распространенность и распределение шести капсульных серотипов Porphyromonas gingivalis у пациентов с пародонтитом. J. Dent. Res. 76 1840–1844 гг. 10.1177 / 00220345970760120601 [PubMed] [CrossRef] [Google Scholar]
- Ли Дж. Й., Соджар Х. Т., Беди Г. С., Дженко Р. Дж. (1992). Синтетические пептиды, аналогичные последовательности фимбриллина, ингибируют адгезию Porphyromonas gingivalis . Заражение. Иммун. 60 1662–1670. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лю К., Хашизуме Т., Курита-Очиай Т., Фуджихаши К., Ямамото М. (2010). Оральная иммунизация с использованием белка внешней мембраны Porphyromonas gingivalis и CpGoligodeoxynucleotides вырабатывает цитокины T-хелперов 1 и 2 для усиления защитного иммунитета. Мол. Oral Microbiol. 25 178–189. 10.1111 / j.2041-1014.2009.00560.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Лю Р., Деста Т., Раптис М., Дарво Р. П., Грейвс Д. Т. (2008). Липополисахариды P. gingivalis и E. coli демонстрируют разную системную, но схожую локальную индукцию маркеров воспаления. J. Periodontol. 79 1241–1247. 10.1902 / jop.2008.070575 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lockhart P.Б., Болджер А. Ф., Папапану П. Н., Осинбовале О., Тревизан М., Левисон М. Э. и др. (2012). Заболевания пародонта и атеросклеротическое заболевание сосудов: подтверждают ли данные независимую связь? Научное заявление Американской кардиологической ассоциации. Тираж 125 2520–2544. 10.1161 / CIR.0b013e31825719f3 [PubMed] [CrossRef] [Google Scholar]
- Лёр Г., Бейклер Т., Подбельски А., Стандарт К., Реданц С., Хенсель А. (2011). Полифенолы Myrothamnus flabellifolia Welw.подавляют адгезию in vitro Porphyromonas gingivalis и оказывают противовоспалительное цитопротекторное действие на клетки KB. J. Clin. Пародонтол. 38 457–469. 10.1111 / j.1600-051X.2010.01654.x [PubMed] [CrossRef] [Google Scholar]
- Мадианос П. Н., Бобетсис Ю. А., Оффенбахер С. (2013). Неблагоприятные исходы беременности (АПО) и заболевания пародонта: патогенетические механизмы. J. Clin. Пародонтол. 40 S170 – S180. 10.1111 / jcpe.12082 [PubMed] [CrossRef] [Google Scholar]
- Maeba S., Отаке С., Намикоши Дж., Сибата Ю., Хаякава М., Абико Ю. и др. (2005). Чрескожная иммунизация 40 кДа белком внешней мембраны Porphyromonas gingivalis индуцирует специфические антитела, которые ингибируют коагрегацию с помощью P. gingivalis . Вакцина 23 2513–2521. 10.1016 / j.vaccine.2004.10.036 [PubMed] [CrossRef] [Google Scholar]
- Маэда К., Триббл Г. Д., Такер К. М., Аная К., Сидзукуиси С., Льюис Дж. П. и др. (2008). Тирозинфосфатаза Porphyromonas gingivalis является многофункциональным регулятором признаков вирулентности. Мол. Microbiol. 69 1153–1164. 10.1111 / j.1365-2958.2008.06338.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Maekawa T., Krauss JL, Abe T., Jotwani R., Triantafilou M., Triantafilou K. , и другие. (2014). Porphyromonas gingivalis манипулирует передачей сигналов комплемента и TLR, чтобы отделить бактериальный клиренс от воспаления и способствовать дисбактериозу. Клеточный микроб-хозяин 15 768–778. 10.1016 / j.chom.2014.05.012 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mahanonda R., Сеймур Г. Дж., Пауэлл Л. В., Гуд М. Ф., Холлидей Дж. У. (1991). Влияние начального лечения хронического воспалительного заболевания пародонта на частоту Т-лимфоцитов периферической крови, специфичных для пародонтопатических бактерий. Oral Microbiol. Иммунол. 6 221–227. 10.1111 / j.1399-302X.1991.tb00481.x [PubMed] [CrossRef] [Google Scholar]
- Maiden M. F., Cohee P., Tanner A. C. (2003). Предложение сохранить форму прилагательного специфического эпитета при реклассификации Bacteroides forsythus Tanner et al .1986 к роду Tannerella Sakamoto et al . 2002 как Tannerella forsythia corrig., Gen. ноя, гребешок. ноя Запрос заключения. Внутр. J. Syst. Evol. Microbiol. 53 2111–2112. 10.1099 / ijs.0.02641-0 [PubMed] [CrossRef] [Google Scholar]
- Мантри К. К., Чен К. Х., Дон Х., Гудвин Дж. С., Пратап С., Паромов В. и др. (2015). Фимбрии-опосредованное образование пузырьков внешней мембраны и инвазия Porphyromonas gingivalis . Microbiologyopen 4 53–65.10.1002 / mbo3.221 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Marcotte H., Lavoie M. C. (1998). Микробная экология полости рта и роль иммуноглобулина слюны A. Microbiol. Мол. Биол. Сборка 62 71–109. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Марес К. Дж., Хеллвард А., Срока А., Адамович К., Белецкая Е., Козиль Дж. И др. (2013). Porphyromonas gingivalis способствует развитию и прогрессированию деструктивного артрита благодаря своей уникальной бактериальной пептидиларгининдезиминазе (PAD). PLoS Pathog. 9: e1003627 10.1371 / journal.ppat.1003627 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mehta A. (2015). Факторы риска, связанные с заболеваниями пародонта, и их клинические аспекты. Внутр. J. Contemp. Вмятина. Med. Сборка 2015 г. 1–15. [Google Scholar]
- Мур У. Э., Мур Л. Х., Рэнни Р., Смиберт Р. М., Бурмейстер Дж. А., Шенкейн Х. А. (1991). Микрофлора участков пародонта показывает активную деструктивную прогрессию. Дж.Clin. Пародонтол. 18 729–739. 10.1111 / j.1600-051X.1991.tb00064.x [PubMed] [CrossRef] [Google Scholar]
- Мур У. Э., Мур Л. В. (1994). Бактерии заболеваний пародонта. Пародонтология 2000 г. 66–77. 10.1111 / j.1600-0757.1994.tb00019.x [PubMed] [CrossRef] [Google Scholar]
- Мураками Ю., Кавата А., Ито С., Катаяма Т., Фудзисава С. (2015). Активность по улавливанию радикалов и цитотоксичность ресвератрола, орцинола и 4-аллилфенола и их ингибирующие эффекты на экспрессию гена cox-2 и активацию Nf-κb в RAW264.7 клеток стимулировали Porphyromonas gingivalis -fimbriae. In Vivo 29 341–349. [PubMed] [Google Scholar]
- На Х., Лим Э., Чон С., Рю М., Пак М., Чунг Дж. (2014). Экспрессия ингибитора активатора плазминогена типа 1, индуцированная липополисахаридом Porphyromonas gingivalis в фибробласте десны человека. J. Microbiol. 52 154–160. 10.1007 / s12275-014-3022-7 [PubMed] [CrossRef] [Google Scholar]
- Nagano K., Hasegawa Y., Yoshida Y., Йошимура Ф. (2015). Главный фимбрилиновый вариант фимбрий Mfa1 в Porphyromonas gingivalis . J. Dent. Res. 94 1143–1148. 10.1177 / 0022034515588275 [PubMed] [CrossRef] [Google Scholar]
- Накано К., Инаба Х., Номура Р., Немото Х., Такеда М., Йошиока Х. и др. (2006). Обнаружение кариесогенного Streptococcus mutans в образцах экстирпированного сердечного клапана и атероматозных бляшек. J. Clin. Microbiol. 44 год 3313–3317. 10.1128 / JCM.00377-06 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Nikaido H.(2003). Пересмотр молекулярных основ проницаемости бактериальной внешней мембраны. Microbiol. Мол. Биол. Сборка 67 593–656. 10.1128 / MMBR.67.4.593-656.2003 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Нисенгард Р. Дж., Ньюман М. Г. (1994). Oral Microbiol Immunol. Филадельфия: W.B. Компания Сондерс. [Google Scholar]
- Оффенбахер С. (1996). Заболевания пародонта: патогенез. Ann. Пародонтол. 1 821–878. 10.1902 / annals.1996.1.1.821 [PubMed] [CrossRef] [Google Scholar]
- Огава Т., Яги Т. (2010). Биоактивный механизм липида A Porphyromonas gingivalis . Пародонтология 2000 г. 71–77. 10.1111 / j.1600-0757.2009.00343.x [PubMed] [CrossRef] [Google Scholar]
- Оливейра Ф. А. Ф., Форте С. П. Ф., Сильва П. Г., Лопес С. Б., Черногория Р. К., Сантос А. К. и др. (2015). Молекулярный анализ бактерий полости рта в сердечном клапане пациентов с сердечно-сосудистыми заболеваниями с помощью полимеразной цепной реакции в реальном времени. Медицина 94: e2067 10.1097 / MD.0000000000002067 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Парахитиява Н.Б., Скалли К., Люнг В. К., Ям В. К., Джин Л. Дж., Самаранаяке Л. П. (2010). Изучение бактериальной флоры полости рта: текущее состояние и будущие направления. Устный дис. 16 136–145. 10.1111 / j.1601-0825.2009.01607.x [PubMed] [CrossRef] [Google Scholar]
- Пастер Б. Дж., Олсен И., Аас Дж. А., Дьюхерст Ф. Э. (2006). Широта бактериального разнообразия в пародонтальном кармане человека и других участках полости рта. Пародонтология 2000 г. 80–87. 10.1111 / j.1600-0757.2006.00174.x [PubMed] [CrossRef] [Google Scholar]
- Pennisi E.(2005). Полный рот микробов. Наука 307 1899–1901. 10.1126 / science.307.5717.1899 [PubMed] [CrossRef] [Google Scholar]
- Петерсен П. Э., Огава Х. (2012). Глобальное бремя заболеваний пародонта: к интеграции с профилактикой хронических заболеваний и борьбой с ними. Пародонтология 2000 г. 15–39. 10.1111 / j.1600-0757.2011.00425.x [PubMed] [CrossRef] [Google Scholar]
- Potempa J., Banbula A., Travis J. (2000). Роль бактериальных протеиназ в разрушении матрикса и модуляции ответов хозяина. Пародонтология 2000 г. 153–192. 10.1034 / j.1600-0757.2000.2240108.x [PubMed] [CrossRef] [Google Scholar]
- Приядаршини Р., Куджини К., Арндт А., Чен Т., Тьокро Н. О., Гудман С. Д. и др. (2013). Связанный с нуклеоидом белок HUβ влияет на глобальную экспрессию генов у Porphyromonas gingivalis . Микробиология 159 219–229. 10.1099 / mic.0.061002-0 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Розен Г., Села М. Н. (2006). Коагрегация Porphyromonas gingivalis и Fusobacterium nucleatum PK 1594 опосредуется капсульным полисахаридом и липополисахаридом. FEMS Microbiol. Lett. 256 304–310. 10.1111 / j.1574-6968.2006.00131.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2010). Идентификация нового белка внешней мембраны Porphyromonas gingivalis , PG534, необходимого для производства активных гингипаинов. FEMS Microbiol. Lett. 310 168–174. 10.1111 / j.1574-6968.2010.02059.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2014). Porphyromonas gingivalis C-концевая сигнальная пептидаза PG0026 и HagA взаимодействуют с белком внешней мембраны PG27 / LptO. Мол. Oral Microbiol. 29 32–44. 10.1111 / omi.12043 [PubMed] [CrossRef] [Google Scholar]
- Сайто С., Хирацука К., Хаякава М., Такигучи Х., Абико Ю. (1997). Ингибирование колонизирующего фактора Porphyromonas gingivalis между Actinomyces viscosus ATCC 19246 с помощью моноклональных антител против рекомбинантного белка внешней мембраны 40 кДа. Gen. Pharmacol. 28 год 675–680. 10.1016 / S0306-3623 (96) 00366-7 [PubMed] [CrossRef] [Google Scholar]
- Сареми А., Нельсон Р. Г., Таллох-Рид М., Хэнсон Р. Л., Сиверс М. Л., Тейлор Г. В. и др. (2005). Заболевания пародонта и смертность при диабете 2 типа. Уход за диабетом 28 год 27–32. 10.2337 / diacare.28.1.27 [PubMed] [CrossRef] [Google Scholar]
- Шмидт Дж., Йенч Х., Стингу К.-С., Сак У. (2014). Общий иммунный статус и микробиология полости рта у пациентов с различными формами пародонтита и здоровых лиц контрольной группы. PLoS ONE 9: e109187 10.1371 / journal.pone.0109187 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шах Х.Н., Коллинз М. Д. (1988). Предложение о реклассификации Bacteroides asaccharolyticus, Bacteroides gingivalis и Bacteroides endodontalis в новый род, Porphyromonas . Внутр. J. Sys. Бактериол. 38 128–131. 10.1099 / 00207713-38-1-128 [CrossRef] [Google Scholar]
- Sharma A., Sojar H. T., Lee J. Y., Genco R.J. (1993). Экспрессия функционального полипептида фимбриллина Porphyromonas gingivalis в Escherichia coli : очистка, физико-химическая и иммунохимическая характеристика и характеристики связывания. Заражение. Иммун. 61 3570–3573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шибата Ю., Хирацука К., Хаякава М., Широза Т., Такигучи Х., Нагацука Ю. и др. (2003). Фактор коагрегации 35 кДа представляет собой гемин-связывающий белок в Porphyromonas gingivalis . Biochem. Биофиз. Res. Commun. 300 351–356. 10.1016 / S0006-291X (02) 02826-7 [PubMed] [CrossRef] [Google Scholar]
- Silhavy T. J., Kahne D., Walker S. (2010). Оболочка бактериальной клетки. Cold Spring Harb. Перспектива. Биол. 2: a000414 10.1101 / cshperspect.a000414 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Singh A., Wyant T., Anaya-Bergman C., Aduse-Opoku J., Brunner J., Laine ML, et. al. (2011). Капсула Porphyromonas gingivalis приводит к снижению воспалительной реакции хозяина, уклонению от фагоцитоза и увеличению вирулентности. Заражение. Иммун. 79 4533–4542. 10.1128 / IAI.05016-11 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Slots J., Брэгд Л., Викстром М., Дален Г. (1986). Встречаемость Actinobacillus actinomycetemcomitans, Bacteroides gingivalis и Bacteroides intermediateus при деструктивных заболеваниях пародонта у взрослых. J. Clin. Пародонтол. 13 570–577. 10.1111 / j.1600-051X.1986.tb00849.x [PubMed] [CrossRef] [Google Scholar]
- Срока А., Штуковска М., Потемпа Дж., Трэвис Дж., Дженко К. А. (2001). Расщепление гемовых белков хозяина лизин- и аргинин-специфическими цистеиновыми протеиназами (гингипаинами) Porphyromonas gingivalis . J. Bacteriol. 183 5609–5616. 10.1128 / JB.183.19.5609-5616.2001 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Таннер А. К., Хаффер К., Браттхолл Г. Т., Висконти Р. А., Сокранский С. С. (1979). Исследование бактерий, вызывающих прогрессирование пародонтита у человека. J. Clin. Пародонтол. 6 278–307. 10.1111 / j.1600-051X.1979.tb01931.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1986). Неспецифическая теория микробной этиологии воспалительных заболеваний пародонта. J. Clin. Пародонтол. 13 905–911. 10.1111 / j.1600-051X.1986.tb01425.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1990). Факторы, контролирующие микрофлору здорового рта человека. Бока-Ратон, Флорида: CRC Press. [Google Scholar]
- Тьокро Н. О., Рокко К. Дж., Приядаршини Р., Дэйви М. Э., Гудман С. Д. (2014). Биохимический анализ взаимодействия белка Porphyromonas gingivalis HU PG0121 с ДНК. PLoS ONE 9: e
10.1371 / journal.pone.00
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Трэвис Дж., Пайк Р., Имамура Т., Потемпа Дж. (1997). Porphyromonas gingivalis протеиназы как факторы вирулентности в развитии пародонтита. J. Пародонтология. Res. 32 120–125. 10.1111 / j.1600-0765.1997.tb01392.x [PubMed] [CrossRef] [Google Scholar]
- Ван Стинберген Т. Дж., Делемар Ф. Г., Намавар Ф., Де Граафф Дж. (1987). Различия в вирулентности между видами Bacteroides gingivalis. Антони Ван Левенгук 53 233–244. 10.1007 / BF003 [PubMed] [CrossRef] [Google Scholar]
- Ватанабэ К., Ямаджи Ю., Умемото Т. (1992). Корреляция между клеточной адгезивной активностью и структурой поверхности у Porphyromonas gingivalis . Oral Microbiol. Иммунол. 7 357–363. 10.1111 / j.1399-302X.1992.tb00636.x [PubMed] [CrossRef] [Google Scholar]
- Wiebe C. B., Putnins E. E. (2000). Система классификации заболеваний пародонта Американской академии пародонтологии — обновление. J. Can. Вмятина. Доц. 66 594–597. [PubMed] [Google Scholar]
- Уильямс К. Э., Давенпорт Э. С., Стерн Дж. А., Сивапатхасундарам В., Ферн Дж. М., Кертис М. А. (2000). Механизмы риска у недоношенных новорожденных с низкой массой тела. Пародонтология 2000 г. 142–150. 10.1034 / j.1600-0757.2000.2230115.x [PubMed] [CrossRef] [Google Scholar]
- Уильямс Р. О., Фельдманн М., Майни Р. Н. (1992). Фактор противоопухолевого некроза облегчает заболевание суставов при артрите, индуцированном коллагеном у мышей. Proc. Natl. Акад. Sci. США 89 9784–9788. 10.1073 / pnas.89.20.9784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ян Дж., Ву Дж., Лю Ю., Хуанг Дж., Лу З., Се Л. и др. . (2014). Porphyromonas gingivalis Инфекция снижает уровень регуляторных Т-лимфоцитов у инфицированных пациентов с атеросклерозом. PLoS ONE 9: e86599 10.1371 / journal.pone.0086599 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Йемваттана И., Каомонгколгит Р. (2015).Альфа-мангостин подавляет экспрессию IL-6 и IL-8 в P. gingivalis LPS-стимулированных фибробластах десен человека. Стоматология 103 348–355. 10.1007 / s10266-014-0160-7 [PubMed] [CrossRef] [Google Scholar]
- Йошимура А., Хара Ю., Канеко Т., Като И. (1997). Секреция ИЛ-1 бета, ФНО-альфа, ИЛ-8 и ИЛ-1ra полиморфно-ядерными лейкоцитами человека в ответ на липополисахариды пародонтопатических бактерий. J. Periodontal Res. 32 279–286. 10.1111 / j.1600-0765.1997.tb00535.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Мураками Ю., Нисикава К., Хасегава Ю., Каваминами С. (2009). Компоненты поверхности Porphyromonas gingivalis . J. Periodontal Res. 44 год 1–12. 10.1111 / j.1600-0765.2008.01135.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Ватанабе К., Такасава Т., Каванами М., Като Х. (1989). Очистка и свойства 75-килодальтонного основного белка, иммунодоминантного поверхностного антигена, из орального анаэроба Bacteroides gingivalis. Заражение. Иммун. 57 год 3646–3652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зенобия К., Хаджишенгаллис Г. (2015). Porphyromonas gingivalis Факторы вирулентности, участвующие в разрушении лейкоцитов и микробном дисбактериозе. Вирулентность 6 236–243. 10.1080 / 21505594.2014.999567 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhang T., Hashizume T., Kurita-Ochiai T., Yamamoto M. (2009). Сублингвальная вакцинация белком внешней мембраны Porphyromonas gingivalis и лигандом Flt3 вызывает защитный иммунитет в полости рта. Biochem. Биофиз. Res. Commun. 390 937–941. 10.1016 / j.bbrc.2009.10.081 [PubMed] [CrossRef] [Google Scholar]
- Чжан В., Джу Дж., Ригни Т., Триббл Г. Д. (2011). Фимбрии Porphyromonas gingivalis важны для начальной инвазии остеобластов, но не для ингибирования их дифференцировки и минерализации. J. Periodontol. 82 909–916. 10.1902 / jop.2010.100501 [PubMed] [CrossRef] [Google Scholar]
Обзор пародонтопатогенных микроорганизмов ниже линии десен
Front Microbiol.2016; 7: 53.
Kah Yan How
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
Кеанг Пенг Сонг
2 Школа Science, Университет Монаш, кампус Sunway, Субанг-Джая, Малайзия
Кок Ган Чан
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
2 Школа естественных наук, Университет Монаш Кампус Санвей, Субанг Джая, Малайзия
Отредактировал: Laurel L .Ленц, Медицинский факультет Университета Колорадо, США
Рецензент: Пол Фиш, Медицинский центр Университета Фрайбурга, Германия; Чарльз С. Колдуэлл, Университет Цинциннати, США
Эта статья была отправлена в Microbial Immunology, раздел журнала Frontiers in Microbiology
Поступила 31 октября 2015 г .; Принято 12 января 2016 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) или лицензиара и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Заболевания пародонта представляют собой группу воспалительных инфекций полости рта, вызываемых патогенами полости рта, которые существуют в виде сложных биопленок на поверхности зуба и вызывают разрушение опорных тканей зуба.Тяжесть этого заболевания варьируется от легкого и обратимого воспаления десен (гингивита) до хронического разрушения соединительных тканей, образования пародонтального кармана и, в конечном итоге, приводит к потере зубов. В то время как поддесневой налет человека содержит более 500 видов бактерий, обширные исследования показали, что Porphyromonas gingivalis , грамотрицательная анаэробная бактерия, является основным этиологическим агентом, вызывающим хронический пародонтит. Эта бактерия с черным пигментом продуцирует множество факторов вирулентности, которые прямо или косвенно вызывают разрушение тканей пародонта, модулируя воспалительную реакцию хозяина.Здесь в этом обзоре представлен обзор P. gingivalis и того, как его факторы вирулентности влияют на патогенез с другим консорциумом микробиома в полости рта.
Ключевые слова: Porphyromonas gingivalis , оральный возбудитель, пародонтоз, гингивит, факторы вирулентности, воспалительная реакция
Введение
Заболевания пародонта — сложные, многофакторные, полимикробные инфекции, характеризующиеся разрушением поддерживающих зуб тканей.Заболевание начинается с острого воспаления десневой ткани и невылеченных инфекций, которые могут прогрессировать до образования карманов в зубах и, в конечном итоге, потери зубов. По данным Всемирной организации здравоохранения, заболевания пародонта поражают 10–15% взрослого населения во всем мире (Petersen and Ogawa, 2012).
Существенные данные, накопленные за эти годы, указывают на участие лишь небольшой части бактерий, обитающих в поддесневой нише, в возникновении и прогрессировании заболеваний пародонта.Существуют убедительные доказательства, указывающие на Porphyromonas gingivalis , грамотрицательные анаэробы, как на ключевой вид в развитии хронического пародонтита.
В последние десятилетия обширных исследований P. gingivalis были получены различные доказательства вклада этого анаэроба в прогрессирование периондонта. Эти данные важны для улучшения нашего понимания характеристик вирулентности и клеточного взаимодействия между P.gingivalis и хозяина, тем самым выясняя потенциальные терапевтические подходы к контролю прогрессирования заболеваний пародонта.
Флора ротовой полости и нормальный периодонт
Ротовая полость обладает рядом особенностей, которые делают ее особой средой обитания для целого зверинца микроорганизмов. Поверхности ротовой полости большую часть времени непрерывно омываются слюной в узком диапазоне температур (от 34 до 36 ° C) и pH, близком к нейтральному (Marcotte and Lavoie, 1998). Обнаружено, что в такой идеальной среде различные классы микрофлоры распределены в различных экологических нишах (Parahitiyawa et al., 2010).
В целом во рту обитает не менее шести миллиардов бактерий, которые представлены более чем 700 видами (Theilade, 1990; Aas et al., 2005), а также другими типами микроорганизмов, включая грибы, микоплазмы, простейшие и возможно, даже вирусы (Pennisi, 2005). Как правило, бактерии полости рта можно в широком смысле классифицировать как грамположительные и грамотрицательные бактерии, а также как анаэробные или факультативно анаэробные в соответствии с их потребностями в кислороде. Некоторые из наиболее часто выделяемых микроорганизмов в ротовой полости человека перечислены в таблице Таблица .
Таблица 1
Преобладающая микробиота полости рта человека.
| Группа микробов | Род / вид микробов |
|---|---|
| Грам-положительный | |
| Аэробный или факультативный | Стрептококк (S. gordonii, S. mitis, S. auralis, S. salivarius) |
| Стафилококк (S. aureus, S. epidermidis) | |
| Энтерококк (E.faaecalis) | |
| Lactobacillus (L. casei, L. fermentum) | |
| Коринебактерии (C. matruchotii) | |
| Actinomyces (A. naeslundii, A. israelli, A. viscosus) | |
| Арахния (A. propionica) | |
| Ротия (R. dentocariosa) | |
| Облигатные анаэробы | Bacillus (B.cereus) |
| Propionibacterium (P. acnes) | |
| Пептострептококк (P. micros, P. anaerobius) | |
| Грамотрицательные | |
| Аэробный или факультативный | Campylobacter (C. rectus, C. concisus, C. gracilis) |
| Actinobacillus (A. actinomycetemcomitans) | |
| Облигатные анаэробы | Fusobacterium (F.nucleatum) |
| Porphyromonas (P. gingivalis) | |
| Prevotella (P. melaninogenica, P. oralis, P. intermedia) |
микробиота, ротовая полость, тем не менее, характеризуется стабильным сообществом, известным как сообщество климакса. Следовательно, если возникает дисбаланс в микробиоте, постоянно проживающей в ротовой полости, появляются такие заболевания полости рта, как кариес и заболевания пародонта, что приводит к размножению потенциально патогенных микроорганизмов.Несколько исследований показали, что изменение видов микробов в десневой борозде с грамположительных, факультативных, ферментативных микроорганизмов на преимущественно грамотрицательные, анаэробные, хемоорганотрофные и протеолитические организмы в значительной степени связано с разрушением тканей пародонта (Eloe-Fadrosh and Раско, 2013).
Заболевания пародонта
Заболевания пародонта обычно относятся к воспалительному патологическому состоянию десны и поддерживающих структур пародонта, включая десну, альвеолярную кость, периодонтальную связку и цемент.Они обычно встречаются в большинстве человеческих популяций и приводят к значительной заболеваемости с отслаиванием зубов в тяжелом состоянии. В Соединенных Штатах последние эпидемиологические данные показывают, что заболевание периондонта поражает половину населения в возрасте старше 30 лет и является основной причиной потери зубов среди взрослых (Bostanci and Belibasakis, 2012). Согласно системе классификации заболеваний пародонта, предложенной Американской академией пародонтологии (AAP), заболевания пародонта обычно делятся на две основные категории: заболевания десен и пародонтит, в зависимости от того, произошло ли разрушение прикрепления пародонта (Wiebe and Putnins, 2000). ).
Заболевание десен определяется как воспаление тканей десны, вызванное скоплением зубного налета, и клинически характеризуется покраснением, отеком и кровотечением тканей. Поскольку периодонтальная связка и альвеолярная кость не вовлечены в это событие, прикрепление зубов не затрагивается (Williams et al., 1992). Гингивит может сохраняться неопределенно долго в течение длительного периода и не перерастет в пародонтит, если нет нарушений местных условий или общей восприимчивости хозяина (Offenbacher, 1996).
С другой стороны, пародонтит относится к необратимому воспалению тканей пародонта, вызванному бляшками, которое приводит к разрушению периодонтальной связки и альвеолярной кости и миграции эпителиальной связки. Впоследствии это вызывает образование пародонтального кармана, что является основным клиническим признаком пародонтита (Williams et al., 1992). Этот карман является идеальной поверхностью для бактериальной колонизации и образования поддесневого налета.
Различные исследования показали, что пародонтит чаще встречается у пациентов с системными заболеваниями, такими как сахарный диабет, СПИД, лейкемия и синдром Дауна (Komatsu, 2014; Mehta, 2015).Все больше данных свидетельствует о том, что пародонтит может повышать риск нескольких потенциально смертельных состояний, включая сердечно-сосудистые заболевания (например, сердечный приступ, ишемическую болезнь сердца и инсульт) и диабет (Saremi et al., 2005; Friedewald et al., 2009) . Согласно отчету AAP в 1996 году, было обнаружено, что люди с некоторыми формами заболеваний десен почти в два раза чаще страдают ишемической болезнью сердца по сравнению с людьми со здоровыми деснами.
В течение многих лет проводились многочисленные исследования, показывающие возможную связь между заболеваниями пародонта и сердечно-сосудистыми заболеваниями.Недавние исследования, такие как исследование Nakano et al. (2006) попытались показать прямые механизмы, связывающие заболевания пародонта с сердечно-сосудистыми заболеваниями. Для объяснения этой ассоциации был предложен ряд механизмов, включая общий фактор, который предрасполагает некоторых людей к гипервоспалительной реакции при сердечно-сосудистых заболеваниях (Beck et al., 1996). Считается, что оральные патогены могут попадать в кровоток, а воспаление, вызванное заболеваниями пародонта, увеличивает образование зубного налета, что впоследствии способствует расширению артерий (Bartold and Narayanan, 2006). На рисунке показана упрощенная диаграмма потенциальных ролей, которые воспаление пародонта может играть в патогенезе сердечно-сосудистых заболеваний.
Упрощенное изображение, показывающее связь хронического воспаления пародонта и патогенеза сердечно-сосудистых заболеваний. По материалам Bartold and Narayanan (2006).
Streptococcus mutans , основной патогенный агент кариеса зубов, обнаруживался с необычно высокой частотой как в тканях сердечного клапана, так и в образцах атероматозных бляшек, чем любые другие виды (Nakano et al., 2006). Фактически, вместе с P. gingivalis ранее было обнаружено, что S. mutans ускоряет образование атерогенных бляшек на мышиной модели и вызывает агрегацию тромбоцитов, что предположительно приводит к образованию тромба (Herzberg and Meyer, 1996; Kuramitsu et al., 2001 ). Последнее исследование Oliveira et al. (2015) показали, что S. mutans, Prevotella intermedia, P. gingivalis и Treponema denticola часто обнаруживались в образцах сердечного клапана с использованием метода полимеразной цепной реакции (ПЦР), что подтверждает предыдущие выводы.Высокая частота обнаружения S. mutans в образцах зубного налета может свидетельствовать о том, что S. mutans , обнаруженные в образцах клапана, произошли из полости рта. Однако есть опасения по поводу возможности обнаружения ДНК мертвых бактерий из-за высокой чувствительности ПЦР в реальном времени.
С другой стороны, Американская кардиологическая ассоциация отметила, что ни пародонтоз не вызывает атеросклеротическое заболевание сосудов, ни лечение пародонта не предотвращает атеросклеротическое сосудистое заболевание (Lockhart et al., 2012). Это было подтверждено отчетом Hayashi et al. (2015), в которых отсутствует сильная корреляция между состоянием пародонта и параметрами статуса артериосклероза у пациентов с ишемической болезнью сердца. Однако это исследование также имеет некоторые ограничения, например, пациенты без ишемической болезни сердца были исключены, а образцы биомаркеров не были собраны из разных областей полости рта, чтобы отразить местные воспалительные состояния.
Сообщалось, что заболевания пародонта и сердечно-сосудистые заболевания имеют общие факторы риска, такие как курение, сахарный диабет, старение и ожирение (Genco and Borgnakke, 2013).Системные воспалительные маркеры также были обнаружены при обоих заболеваниях. Следовательно, доказательство корреляции между этими двумя заболеваниями остается сложной задачей. Другие общие факторы, включая образ жизни и личную гигиену, также сыграли важную роль в обоих заболеваниях. Из-за большого количества противоречивой литературы существует необходимость в дополнительных долгосрочных исследованиях, чтобы установить сильную причинную связь между заболеваниями пародонта и сердца.
Помимо сердечно-сосудистых заболеваний, исследования in vitro, и модели на животных предполагают, что P.gingivalis может нарушать иммунную толерантность у восприимчивых людей и усугублять ревматоидный артрит за счет ферментативной модификации белков хозяина (Maresz et al., 2013). Кроме того, было обнаружено, что пародонтоз является фактором риска для недоношенных детей с низкой массой тела при рождении (Ali and Abidin, 2012). Медиаторы воспаления, возникающие при пародонтозе, играют решающую роль в инициировании родов, и существуют вероятные механизмы, которые могут связать эти два состояния (Williams et al., 2000). Основываясь на эпидемиологических и микробиологических иммунологических исследованиях, постулируемые механизмы включают транслокацию патогенов пародонта в фетоплацентарную единицу и действие пародонтального резервуара факторов вирулентности в качестве медиаторов воспаления. Однако взаимосвязь между неблагоприятными исходами беременности и ответом материнских антител на P. gingivalis требует дальнейшего изучения (Madianos et al., 2013).
Бактериальная этиология заболеваний пародонта
За эти несколько десятилетий были достигнуты большие успехи в понимании патогенеза и естественного течения заболеваний пародонта.Тем не менее, исследования, проведенные в 1930-1970-х годах, не смогли идентифицировать конкретные бактерии как этиологические агенты заболеваний пародонта. Таким образом, была предложена «неспецифическая теория», которая выдвигает гипотезу о том, что заболевание пародонта вызвано консорциумом микроорганизмов, а не важностью каких-либо видов бактерий как единственных возбудителей (Theilade, 1986). Однако в конце 1970-х и позже были выделены более специфические микроорганизмы в качестве этиологических агентов пародонтита (Tanner et al., 1979; Слотс и др., 1986; Мур и Мур, 1994).
В настоящее время широко признано, что мириады бактерий, а не ни один микроорганизм, вовлечены в заболевания пародонта. Фактически, воспаление тканей пародонта вызвано колонизацией поддесневой области бактериями пародонта. Например, на поверхности зубов ранними или первичными колонизаторами являются в основном стрептококки и актиномицеты. Со временем пропорции этих грамположительных факультативно анаэробных бактерий уменьшаются, и в конечном итоге грамотрицательные анаэробы становятся более устойчивыми, особенно на границе раздела зубов и десен (Jenkinson and Lamont, 2006).
Тем не менее, сложные взаимодействия между бактериальной флорой и защитными механизмами хозяина существенно влияют на баланс между бактериальной агрессией и защитой хозяина и, таким образом, определяют, происходит ли разрушение пародонта (Hajishengallis et al., 2012). В свете этих критериев ряд экспериментальных данных продемонстрировал, что первичными этиологическими агентами заболеваний пародонта обычно являются грамотрицательные палочки, которые включают Actinobacillus actinomycetemcomitans, Tannerella forsythia (ранее обозначенные как Bacteroides forsythus ), Prevotella, Fusobacterium , и P.gingivalis. Ни один из этих видов микробов не способен вызывать деструктивные события, связанные с прогрессированием заболеваний пародонта, но этиология требует согласованного взаимодействия этих членов для создания своих ниш в полости рта (Marcotte and Lavoie, 1998; Maiden et al., 2003; Paster et al., 2006).
Porphyromonas Gingivalis и его распространенностьСреди основных патогенов пародонта P. gingivalis , по-видимому, является одним из основных этиологических агентов в патогенезе и прогрессировании воспалительных явлений пародонтоза (Hajishengallis et al., 2012). Эта пародонтопатическая бактерия была обнаружена в 85,75% образцов поддесневого налета от пациентов с хроническим пародонтитом (Datta et al., 2008). Эта неподвижная асахаролитическая грамотрицательная бактерия представляет собой облигатно анаэробную палочку, которая образует колонии с черным пигментом на чашках с кровяным агаром (, фиг. ). В процессе роста ему абсолютно необходимо железо. Ранее он назывался Bacteroides gingivalis до его реклассификации в новый род Porphyromonas (Nisengard and Newman, 1994).Название Porphyromonas происходит от греческого прилагательного porphyreos , означающего пурпурный, и греческого существительного monas , означающего единицу. Следовательно, слово Porphyromonas означает порфириновые клетки, поскольку колонии на пластинах с кровяным агаром становятся черными через 6–10 дней из-за накопления гема (Shah and Collins, 1988).
Черные пигментированные колонии пародонтопатогена P. gingivalis на агаре с лошадиной кровью. Считается, что пигмент связан с накоплением гемина (окисленной формы гема) на поверхности клеток при выращивании на кровяном агаре.
Основным местом обитания P. gingivalis является поддесневая борозда ротовой полости человека. Он основан на ферментации аминокислот для производства энергии, свойства, необходимого для его выживания в глубоком периодонтальном кармане, где доступность сахара низкая (Bostanci and Belibasakis, 2012). Являясь облигатным анаэробом, P. gingivalis служит вторичным колонизатором зубного налета, часто прилипая к первичным колонизаторам, таким как Streptococcus gordonii и P.промежуточный. Исследование Bodet et al. (2006) продемонстрировали, что эта асахаролитическая бактерия связана с T. denticola и T. forsythia с образованием комплекса красных бактерий, который широко распознается при поздних поражениях пародонта. Дополнительные доказательства присутствия P. gingivalis также получены из иммунологических исследований (Moore et al., 1991; Schmidt et al., 2014). Практически все исследователи согласны с тем, что уровни сывороточных антител к P. gingivalis выше у пациентов с диагнозом пародонтит у взрослых (Mahanonda et al., 1991; Casarin et al., 2010).
В последние несколько десятилетий штамм P. gingivalis были классифицированы на инвазивные и неинвазивные штаммы на основе их способности образовывать абсцессы на модели мышей. Было продемонстрировано, что инвазивный штамм P. gingivalis обладает большей патогенной активностью, чем неинвазивный штамм как in vitro , так и in vivo (Dorn et al., 2000; Baek et al., 2015).
Наличие п.gingivalis , действующий либо отдельно, либо как смешанная инфекция с другими оральными патогенами, и, возможно, дефицит определенных иммунологических факторов у хозяина, по-видимому, имеет важное значение для этиологии прогрессирующего пародонтита (Haffajee and Socransky, 1994). Было показано, что количество P. gingivalis значительно увеличивается в участках с пародонтитом и ниже или не обнаруживается на участках с поддесневым здоровьем или гингивитом, связанным с бляшками (Schmidt et al., 2014). Обычно он в большей степени находится в глубоких, чем в неглубоких пародонтальных карманах (Ali et al., 1996). Около 40–100% взрослых пациентов с пародонтитом инфицированы этими условно-патогенными бактериями.
При высокой частоте встречаемости P. gingivalis в очагах пародонтита у взрослых имеется сильная гипотеза, что P. gingivalis взаимодействуют с другими членами микробиоты хозяина, синтезируя различные патогенные факторы, что приводит к прогрессированию заболевания. Однако то, как P. gingivalis взаимодействует с селективными клетками-хозяевами для производства деструктивных биологических молекул и запускает преобразование здоровой ткани ротовой полости в болезненное состояние, еще неизвестно (Holt et al., 1999).
Факторы вирулентности
P. gingivalisИндукция и прогрессирование деструкции тканей пародонта представляют собой сложные процессы, включающие накопление бляшек, высвобождение бактериальных веществ и воспалительную реакцию хозяина. P. gingivalis , как известно, продуцирует набор факторов вирулентности, которые могут проникать в десны и вызывать разрушение тканей прямо или косвенно, вызывая воспаление (Hajishengallis et al., 2012). Факторы вирулентности можно определить как компоненты или метаболиты организма, которые необходимы на различных стадиях жизненного цикла и вызывают повреждение хозяина.Способность организма колонизировать и уклоняться от антибактериальных защитных механизмов хозяина, а также способность производить вещества, которые могут инициировать разрушение тканей, являются неотъемлемыми характеристиками успешного патогена. Некоторые факторы вирулентности приведены в Таблице .
Таблица 2
Факторы вирулентности и эффекторы хозяина, продуцируемые P. gingivalis.
| Факторы вирулентности | Влияние на уклонение от хозяина |
|---|---|
| Ферменты (гиалуронидаза, хондроитинсульфатаза), капсула | Снижение фагоцитоза для инвазии, ингибиторы хемотаксиса B |
| Фимбрии, экзополисахарид, белки внешней мембраны | Адгезия или прикрепление к внешней мембране хозяина |
| Коллагеназа, трипсиноподобная протеаза, желатиназа | Деградация ингибиторов протеаз плазмы, разрушение ткани пародонта |
| Аминопептидаза | Деградация белка транспорта железа |
Чтобы выжить и размножаться в организме хозяина, вторгающемуся патогену необходимо преодолеть внешние защитные барьеры хозяина, прежде чем он сможет найти подходящую экологическую нишу для колонизации.Колонизация тканей хозяина могла происходить только в присутствии факторов вирулентности, таких как фимбрии, капсулы, липополисахарид (ЛПС), липотейхоевые кислоты, гемагглютинины, гингипаины, белки внешней мембраны и везикулы внешней мембраны (Holt et al., 1999; Hajishengallis and Ламонт, 2014). Выражение факторов вирулентности часто регулируется в ответ на изменения во внешней среде пародонтопатогена. Если эти факторы вирулентности активны в восприимчивом хозяине, они могут привести к быстрому и значительному разрушению тканей пародонта, резорбции костей, индукции ответов хозяина за счет продукции цитокинов, а также к ингибированию защитных механизмов хозяина.Однако экспрессия этих детерминант вирулентности и их механизм на различных стадиях заболевания пародонта широко не исследовались. Для полного понимания конкретной функции каждого фактора и его механизма в патогенезе требуется инактивация факторов в сочетании с биохимической оценкой и тестированием на вирулентность in vivo и .
Капсулы
Чтобы прижиться в полости рта, микроорганизмы должны сначала прикрепиться к зубам или поверхностям слизистой оболочки (Yoshimura et al., 2009). Соблюдение режима лечения необходимо для обеспечения сопротивления потоку слюны. Приверженность обычно опосредуется адгезинами на поверхности бактерий и рецепторами на поверхности полости рта. Микробные адгезины обнаруживаются как компоненты клеточной стенки или связаны с клеточными структурами, такими как капсулы или фимбрии (Marcotte and Lavoie, 1998). Химический состав капсулы у разных штаммов различается, главным образом, по составу сахара. Например, P. gingivalis ATCC 53977 не содержит галактозу, но богат аминосахарами. P. gingivalis обнаруживает, по крайней мере, шесть серотипов капсульных антигенов, которые включают K1 – K6 (Laine et al., 1997).
В одном из самых ранних исследований сообщалось, что высокоинкапсулированные штаммы P. gingivalis демонстрируют пониженную аутоагглютинацию, меньшую плотность и более гидрофильны, чем неинкапсулированные штаммы (Van Steenbergen et al., 1987). Согласно Singh et al. (2011), повышенная инкапсуляция также коррелирует с повышенной устойчивостью к фагоцитозу, сывороточной резистентностью и пониженной индукцией хемилюминесценции полиморфно-ядерных лейкоцитов.Кроме того, обнаружено, что капсула участвует в возмущении эпителиальных клеток десны. Исследования Dierickx et al. (2003) выявили, что наличие и тип капсулы оказали значительное влияние на начальную адгезию P. gingivalis к эпителиальным клеткам пародонтального кармана человека. Однако следует отметить, что капсула может взаимодействовать с поверхностным белком, облегчая прикрепление к клеткам-хозяевам. С другой стороны, уровень и механизм коагрегации между P.gingivalis и другой периодопатоген Fusobacterium nucleatum , как было показано, также зависят от капсулы (Rosen and Sela, 2006). Другое исследование Katz et al. (1996) выявили, что вирулентные штаммы P. gingivalis W83 и W50 с более толстыми капсулами вызывают снижение продукции лейкоцитов, чем менее вирулентные штаммы, такие как штамм 376. Это ясно указывает на то, что наблюдаемое различие в штаммах вирулентности является вероятно, из-за разницы в капсульной структуре и адгезионной способности.
Исследования с использованием моделей инфицирования мышей показали, что за счет защиты компонентов микробной поверхности инкапсулированные штаммы P. gingivalis более вирулентны, чем неинкапсулированные штаммы. Неинкапсулированные штаммы обычно вызывают неинвазивные локализованные абсцессы, тогда как инкапсулированные штаммы вызывают инвазивные распространяющиеся флегмонозные инфекции после подкожной инокуляции экспериментальным животным. Неинкапсулированные штаммы также подвергаются усиленному фагоцитозу или быстро убиваются макрофагами и дентритными клетками (Laine et al., 1997). Напротив, с точки зрения эффективности инвазии, капсула P. gingivalis делает ее менее эффективной при проникновении в фибробласты десны по сравнению с некапсулярными штаммами (Irshad et al., 2012). Недавние открытия Brunner et al. (2010) продемонстрировали, что инкапсулированный P. gingivalis способен модулировать ответ хозяина на бактерии за счет снижения синтеза цитокинов интерлейкина-1 (IL-1), IL-6 и IL-8 фибробластами. Помимо своих иммуномодулирующих свойств, на модели абсцесса на мышах было показано, что капсула способствует вирулентности за счет уменьшения фагоцитоза и, таким образом, увеличения выживаемости бактерий в клетках-хозяевах и, в конечном итоге, долгосрочного воспалительного ответа (Singh et al., 2011). Однако влияние окислительного стресса на экспрессию капсулы не принималось во внимание, поскольку эксперименты проводились в анаэробных условиях. Необходимы дальнейшие проверки, чтобы показать более точный вклад капсулы в патогенность. Помимо выживаемости бактерий, капсула также может способствовать увеличению выживаемости за счет снижения бактерицидного эффекта небольшого антимикробного пептида, известного как дефенсины (Igboin et al., 2011). В этом исследовании использовалась модель киллинга Drosophila melanogaster для характеристики реакции хозяина на P.gingivalis инфекция. Следовательно, результаты могут быть не очень значимыми, поскольку Drosophila не является естественным хозяином для P. gingivalis , и взаимодействия хозяин-патоген не могут быть изучены с использованием этого организма.
В последнее десятилетие регуляторные механизмы синтеза капсульной поверхности были объектом пристального внимания. Считается, что механизмы довольно сложны и включают посттранскрипционную регуляцию и экспрессию биосинтетического аппарата из множества локусов.На сегодняшний день у P. gingivalis идентифицировано только два различных регуляторных механизма. One представляет собой тирозинфосфатазу (Ltp1), кодируемую PG1641, которая контролирует экспрессию ряда генов, кодирующих белки, участвующие в синтезе поверхностных полисахаридов. В мутанте с делецией ltp1 экспрессия капсулы К-антигена подавлялась (Maeda et al., 2008). Вторым регуляторным механизмом, который был идентифицирован, является β-субъединица HU белка DNABII (PG0121), которая аналогичным образом вызвала снижение экспрессии локуса синтеза K-антигена у мутанта PG0121 (Priyadarshini et al., 2013; Tjokro et al., 2014). Последнее исследование Bainbridge et al. (2015) продемонстрировали, что молекула антисмысловой РНК, которая кодируется внутри инвертированного повторяющегося элемента из 77 п.н. около 5′-конца генов синтеза капсулы K-антигена, влияет на экспрессию капсульной поверхности вирулентного штамма W83 P. gingivalis . Удаление этого элемента снижает синтез капсулы и изменяет структуру LPS (Bainbridge et al., 2015). Эти основные результаты важны для выяснения регуляторной роли вторичной структуры РНК в модулировании синтеза капсулы К-антигена.Однако неизвестно, является ли антисмысловая РНК подлинной РНК или кодирует сигнальный пептид. Кроме того, неизвестно, могут ли другие регуляторные гены играть роль во взаимодействии с другими белками или ферментами при производстве капсул.
Фимбрии
Фимбрии — это тонкие белковые придатки на поверхности, которые выступают из внешней мембраны бактериальной клетки. Эти структуры длиной 3–25 мкм являются укрытием для большинства штаммов P. gingivalis . Исследование P.gingivalis fimbriae имеет долгую историю, восходящую к 1980-м годам (Handley and Tipler, 1986). Исследования показали, что P. gingivalis экспрессирует две различные фимбрии на своей клеточной поверхности: одна состоит из субъединичного белка (названного FimA или фимбриллин), кодируемого геном fimA (названного длинными или основными фимбриями), а другая субъединица Mfa белок кодируется геном mfa1 (называемым короткими, минорными или фимбриями Mfa1). Несмотря на то, что две фимбрии антигенно различаются и различаются по своему аминокислотному составу, считается, что они способствуют прогрессированию воспалительных реакций пародонта (Amano et al., 2010). Интересно, что основная фимбрия-подобная структура была обнаружена у штамма P. gingivalis , в котором не были обнаружены ни FimA, ни Mfa1 фимбрии. Эти новые фимбрии 53 кДа являются еще одним основным белком внешней мембраны P. gingivalis (Nagano et al., 2015).
В зависимости от штамма белок FimA имеет размер от 40,5 до 49 кДа. Основываясь на аминоконце и последовательностях ДНК, он подразделяется на шесть типов: типы I – V и Ib (Fujiwara et al., 1993; Hajishengallis et al., 2008). Штаммы с типом IV FimA, такие как штаммы W50 и W83, плохо фимбрируются. Штаммы 381, ATCC 33277 и HG565, напротив, представляют собой штаммы типа I с обильно фимбриированными клетками, которые обладают значительной адгезией к тканям хозяина. Сообщалось, что у большинства пародонтальных пациентов были штаммы FimA типа II, за которыми следовали штаммы типа IV (Amano et al., 2004).
Исследования малых фимбрий массой 67 кДа очень ограничены. Клональное разнообразие минорных фимбрий среди штаммов P. gingivalis изучено недостаточно.Подобно белку FimA, отдельные минорные молекулы фимбрий, FimCDE, обнаруживаются в разных штаммах. Исследование Amano et al. (2004) продемонстрировали, что минорные фимбрии стимулировали выработку макрофагами интерлейкина-1α (IL-1α), IL-1β, IL-6 и фактора некроза опухоли-α (TNF-α). Постулируется, что малая фимбрия является причинным фактором резорбции альвеолярной кости в моделях на животных. Это исследование, однако, требует дальнейшей проверки, поскольку клональное разнообразие малых фимбрий неясно, но, вероятно, способствует прогрессированию пародонтита у человека.
Ранние исследования в 1990-х на штаммах P. gingivalis с дефицитом фимбрий выявили важную роль фимбрий в связывании, а также во вторжении в клетки-хозяева (Lee et al., 1992; Sharma et al., 1993). Он также обеспечивает прилипание к широкому спектру субстратов и молекул ротовой полости, включая белки внеклеточного матрикса, эпителиальные и комменсальные бактерии полости рта, такие как стрептококки и Actinomyces viscosus (Amano, 2007). Амано (2010) сообщил, что фимбрии типа II способны прикрепляться к клеточному α 5 β 1 -интегрину, что позволяет бактериям легко поглощаться фагоцитами хозяина и дендритными клетками и вызывает перестройку актинового цитоскелета для облегчения интернализации.Впоследствии это позволяет внутриклеточным бактериям нарушать клеточную функцию хозяина за счет факторов вирулентности (Zenobia and Hajishengallis, 2015; , рисунок ). Сообщалось, что основные фимбрии участвуют в начальной инвазии остеобластов с помощью P. gingivalis , но не являются существенными для последующего ингибирования дифференцировки и минерализации остеобластов (Zhang et al., 2011).
P. gingivalis Манипуляции с входом в дендритные клетки с использованием минорных фимбрий Mfa1 и дополнительных белков. Адгезивные свойства фимбрий позволяют P. gingivalis избегать клеток-хозяев и избегать иммунного надзора. По материалам Зенобии и Хаджишенгаллиса (2015).
Во многих сообщениях утверждается, что остатки FimA в фимбриях связываются с молекулами-мишенями, но сообщается, что минорные компоненты FimCDE критически функционируют как адгезин (Yoshimura et al., 2009). Белок FimA не был существенным для инвазивных способностей везикул внешней мембраны P. gingivalis .Тем не менее, большее количество белковых компонентов, связанных с везикулами, происходящими из фимбриированного штамма, интернализуется в фибробласты десен человека по сравнению с фимбриированным штаммом (Mantri et al., 2015). Кроме того, фимбрия P. gingivalis действуют как важный фактор вирулентности в прогрессировании атеросклероза. Сообщалось, что инфекция P. gingivalis снижает уровень регуляторных Т-клеток (Tregs) у пациентов с атеросклерозом. Во время этого процесса Treg могут играть решающую роль в аутоиммунном ответе.Однако остается неизвестным, связана ли инфекция P. gingivalis с нарушением регуляции Treg во время атеросклероза, и распространенность различных генотипов P. gingivalis FimA во время этого процесса остается неясной (Yang et al., 2014).
Между тем, существуют различные соединения растительного происхождения, используемые для подавления активности P. gingivalis . Два из этих исследований были выполнены Murakami et al. (2015) о противовоспалительной активности кверцетина, ресвератрола и родственных ему соединений, катехина, эпикатехина, орцинола и 4-аллилфенола.Было продемонстрировано, что природные соединения проявляют ингибирующее действие на активность фимбрий P. gingivalis . Однако следует отметить, что необходимы дополнительные исследования различных штаммов P. gingivalis для поддержки вышеупомянутых гипотез, поскольку изменчивость штаммов может иметь различную патогенность.
Липополисахарид (ЛПС)
Липополисахарид (ЛПС) представляет собой относительно большую молекулу размером не менее 10 кДа. Он составляет важный компонент внешней мембраны бактерий (Hamada et al., 1994). В общем, бактериальный LPS состоит из дистального полисахарида (или O-антигена), неповторяющегося «основного» олигосахарида и гидрофобного домена, известного как липид A (или эндотоксин) (Ogawa and Yagi, 2010; , рисунок ). Липид A, самый внутренний компонент, представляет собой биологически активную область LPS, которая может вызывать нарушение регуляции врожденной иммунной системы млекопитающих путем взаимодействия с обоими toll-подобными рецепторами 2 и 4 (Darveau et al., 2004). Он имеет гетерогенные паттерны ацилирования, которые изменяются в зависимости от условий микроокружения и влияют на передачу сигналов иммунной системы хозяина, тем самым способствуя выживанию бактерий в организме хозяина (Al-Qutub et al., 2006).
Схематическая структура липополисахарида (ЛПС) внешней мембраны P. gingivalis . По материалам Ogawa and Yagi (2010).
У грамотрицательных бактерий ЛПС играет важную роль в поддержании клеточной и структурной целостности, а также в контроле проникновения гидрофобных молекул и токсичных химикатов. Фактически, сворачивание и вставка белка внешней мембраны не может происходить в отсутствие LPS (Silhavy et al., 2010).На основании своей биологической активности установлено, что ЛПС является важным патогенным фактором среди многих пародонтопатических бактерий. Ряд исследований сообщил о способности этого компонента внешней мембраны активировать воспалительные реакции хозяина и нарушать процесс ремоделирования костей (Herath et al., 2011; Kato et al., 2014). В клинически здоровом пародонте нормальная воспалительная реакция является фундаментальным компонентом системы защиты хозяина с выработкой IL-1. Считается, что IL-1 играет роль в патогенезе заболеваний пародонта через воспалительные реакции через активацию толл-подобного рецептора 4 (Bartold and Narayanan, 2006; Jain and Darveau, 2010).
Одна из возможных ролей LPS в P. gingivalis заключается в нарушении надзора за врожденным хозяином путем вмешательства в распределение лейкоцитов в непосредственной близости от бактериальной колонизации. Фактически, ЛПС P. gingivalis плохо распознается врожденной системой защиты хозяина по сравнению с ЛПС других грамотрицательных видов (например, Escherichia coli ) (Liu et al., 2008). Помимо этого, была парализована способность эпителиальных клеток десен секретировать хемокин интерлейкин 8 (IL-8), что нарушает активацию нейтрофилов, эозинофилов и базофилов (Yoshimura et al., 1997; Darveau et al., 1998). Это явление, известное как хемокиновый паралич, приводит к устойчивости к окислительному взрыву полиморфноядерными нейтрофилами. В отсутствие эффективной врожденной иммунной защиты хозяина количество пародонтальных бактерий может значительно увеличиться. Рост бактериальной популяции в области десен в сочетании с неспособностью системы защиты хозяина удалить их, согласуется с наблюдаемой этиологией пародонтоза. Помимо индукции синтеза провоспалительных цитокинов, P.gingivalis LPS ингибирует дифференцировку и минерализацию остеобластов в стволовых клетках периодонтальной связки, которые участвуют в регенерации тканей пародонта (Kato et al., 2014).
Кроме того, недавнее исследование на мышах продемонстрировало, что P. gingivalis LPS системно циркулирует более чем у 50% пародонтальных пациентов и, как было установлено, имеет более высокий уровень матриксной металлопротеиназы. Низкий системный LPS запускает воспалительную реакцию в левом желудочке через металлопротеиназу, тем самым вызывая сердечную дисфункцию (DeLeon-Pennell et al., 2013). Кроме того, ЛПС также стимулирует выработку тромбоспондина-1, многофункционального белка внеклеточного матрикса, секретируемого моноцитарными клетками человека. Тромбоспондин-1 стимулирует миграцию макрофагов и модулирует воспалительный ответ хозяина (Gokyu et al., 2014). Воспалительные реакции опосредуются множеством генов. Одним из них является мРНК-связывающий белок ингибитора активатора плазминогена типа I (PAI-1), который, как сообщалось, активируется в воспалительной десне при индуцировании P.gingivalis LPS (Na et al., 2014). Несмотря на то, что PAI-1 играет решающую роль в миграции клеток, необходимы дальнейшие исследования, чтобы понять функцию системы активатора плазминогена в сигнальном пути клетки.
Растущее количество свидетельств показывает, что некоторые природные соединения проявляют ингибирующее действие на ЛПС. Сообщалось, что альфа-мангостин вызывает снижение экспрессии IL-6 и IL-8 в фибробластах десен человека (Yiemwattana and Kaomongkolgit, 2015). Более недавнее открытие Ci et al.(2015) продемонстрировали ингибирующее действие экстрактов проантоцианидина виноградных косточек на ЛПС P. gingivalis , в то время как Derradjia et al. (2015) сообщили о роли альфа-токоферола в противодействии повреждающему эффекту ЛПС за счет снижения воспалительных цитокинов, увеличения бета-дефенсинов, антимикробного пептида и стимулирования роста и миграции фибробластов десны. С другой стороны, торментиновая кислота ингибирует LPS-индуцированный воспалительный ответ в фибробластах десен человека (Jian et al., 2015). Поскольку обнаружено, что мучная кислота обладает противовоспалительным действием, ингибируя выработку IL-6 и IL-8, она может быть возможным терапевтическим агентом при заболеваниях пародонта.
В недавнем исследовании Díaz et al. (2015) было обнаружено, что различия в профиле ЛПС клинических изолятов P. gingivalis влияют на морфологию колоний и устойчивость к полимиксину B. В отличие от здоровых субъектов, изоляты от субъектов пародонта обладали устойчивостью к полимиксину B и демонстрировали низкую способность к агрегации.Эта устойчивость сильно коррелирует с вариациями в профилях ЛПС, так как ЛПС здоровых субъектов не имеет высокомолекулярных антигенных составляющих O и анионного полисахарида (Díaz et al., 2015), тогда как изоляты P. gingivalis от пародонта продуцируют модифицированные липиды. Молекулы. Однако роль других компонентов ЛПС плохо изучена, и участие других факторов вирулентности в реакции на противомикробные соединения не принималось во внимание.
Еще один важный момент, на который стоит обратить внимание, — это экспрессия LPS в различных P.gingivalis , и их роль на различных стадиях инфекции до сих пор остается спорной. Одной из основных причин предположительно могло быть использование различных штаммов P. gingivalis , которые неизбежно плейотропны по отношению к другим патогенным свойствам. Следовательно, основа вариабельности ЛПС у разных штаммов еще не установлена.
Протеазы
Способность большинства штаммов P. gingivalis секретировать многочисленные гидролитические, протеолитические и липолитические ферменты вместе с токсичными метаболитами является одной из характеристик вирулентности, которая позволяет этим бактериям процветать в полости рта.Эти ферменты обычно находятся в непосредственной близости с клетками-хозяевами. В то время как некоторые ферменты находятся в периплазматическом пространстве, другие переносятся из внешней мембраны в пузырьки внешней мембраны во время роста. Один из типов ферментов, протеазы, по-видимому, сильно влияет на прогрессирование заболеваний пародонта. Среди этих протеаз — трипсин-, тиол-, казеинолитические протеиназы и пептидазы (Travis et al., 1997; Curtis et al., 2001).
Обычно существует два различных семейства протеаз, продуцируемых P.gingivalis . Одно из них — это семейство цистеиновых протеиназ, также известное как «трипсиноподобный» фермент, а другое — сериновая протеиназа (Bostanci and Belibasakis, 2012). «Трипсиноподобные» ферменты расщепляют полипептиды на С-конце после остатка аргинина или лизина. Эти протеиназы, обычно известные как гингипаины, а именно гингипаин R и K, расщепляются после аргинина и лизина соответственно. В совокупности они обеспечивают 85% внеклеточной протеолитической активности P. gingivalis в очаге инфекции (de Diego et al., 2014). Существует два типа гингипаина R, а именно RgpA и RgpB, и один тип гингипаина K, Kgp. Гингипаин R разрушает компоненты внеклеточного матрикса, включая интегрин-фибронектин-связывающий, цитокин, иммуноглобулин и факторы комплемента (Curtis et al., 2001). Это также жизненно важно для обработки и созревания основных фимбрий (FimA) (Kristoffersen et al., 2015). И гингипаин R, и K были выделены из многих штаммов P. gingivalis , выращенных в различных условиях.
Имеются убедительные доказательства того, что протеазы P. gingivalis непосредственно участвуют в колонизации пародонтального кармана, что приводит к разрушению поддерживающей ткани пародонта (Andrian et al., 2004; Dubin et al., 2013). Кроме того, протеазы также придают микроорганизмам высокую устойчивость к защитным механизмам хозяина. Обширные исследования за последнее десятилетие показали, что протеазы P. gingivalis участвуют в деградации белков внеклеточного матрикса, таких как коллаген, активации металлопротеиназ матрикса хозяина, инактивации ингибиторов протеиназ плазмы, расщеплении рецепторов на поверхности клетки и нарушении регуляции воспалительные (Potempa et al., 2000; Имамура и др., 2003). Они также являются важными дополнительными агентами для роста T. forsythia и A. actinomycetemcomitans в смешанной биопленке с P. gingivalis (Bao et al., 2014; Haraguchi et al., 2014).
Было обнаружено, что гингипаин разрушает фибриноген и белки гема хозяина, которые способствуют ингибированию свертывания крови и увеличивают кровотечение, тем самым повышая доступность гемина для роста бактерий (Sroka et al., 2001).Следовательно, не может быть удивительным обнаружение высокой пролиферации P. gingivalis в пародонтальных карманах, в которых много эритроцитов. Гингипаины также считаются важными по своей способности расщеплять антибактериальные пептиды, такие как нейтрофильные α-дефенсины, факторы комплемента, такие как C3 и C4, рецепторы Т-клеток, такие как CD4 и CD8 (Hajishengallis et al., 2013; Bao et al. др., 2014). Они также снижают экспрессию рецепторов врожденного иммунитета CD14, что приводит к гипореактивности макрофагов к бактериальной инфекции.Однако вопрос о том, связана ли снижение экспрессии CD14 с пародонтитом, вызванным P. gingivalis , требует дальнейшего выяснения. В недавней работе Maekawa et al. (2014), P. gingivalis и его гингипаины, активно манипулируют молекулами хозяина, например, препятствуя перекрестному обмену сигналами между рецептором C5a и толл-подобным рецептором, чтобы предотвратить бактериальный клиренс. Исследования in vitro продемонстрировали, что гингипаины участвуют в регуляции медиаторов воспаления из различных клеток-хозяев, включая IL-1α, IL-1β, IL-18 (Hamedi et al., 2009), рецептор, активируемый протеазой (PAR) -2 (Belibasakis et al., 2010), или растворимый запускающий рецептор, экспрессируемый на миелоидных клетках (sTREM) -1 (Bostanci et al., 2013). Тем не менее, до такой степени нет конкретных доказательств одновременного действия гингипаинов на эти медиаторы воспаления при прогрессировании пародонтита.
Райн, антрахинон из корней ревеня, проявляет антибактериальный синергетический эффект с другими полифенолами. Он вызывает подавление двух генов протеаз, rgpA и kgp, которые связаны с инактивацией защитных механизмов хозяина и разрушением тканей (Azelmat et al., 2015). С другой стороны, теафлавины, основные полифенолы в черном чае, заметно ингибируют протеиназную активность гингипаинов P. gingivalis в зависимости от дозы (Kong et al., 2015). Синтетический двойной ингибитор протеазы, названный KYT-41, был синтезирован, и было обнаружено, что он обладает сильной антибактериальной активностью против P. gingivalis . Этот двойной ингибитор протеаз Rgp и Kgp проявляет противовоспалительную активность, поэтому считается многообещающим средством для профилактики и лечения гингивита (Kataoka et al., 2014).
Белки внешней мембраны
Клеточная оболочка грамотрицательных бактерий, таких как Porphyromonas sp. состоит из двух клеточных мембран, внешней мембраны (OM) и внутренней мембраны (IM). Оба слоя мембран имеют разный состав и структуру. Они разделены периплазмой, содержащей слой пептидогликана. В то время как IM представляет собой бислой фосфолипидов с многочисленными интегральными белками IM (Bos et al., 2007), OM представляет собой асимметричный бислой, который состоит из фосфолипидов и липополисахаридов во внутреннем и внешнем листках, соответственно.Мембрана бактериальной клетки играет роль селективного барьера, обеспечивающего защиту и позволяющего перемещаться различным веществам через пориновые белки ОМ (Nikaido, 2003). Белки OM обычно делятся на две категории: липопротеины OM, которые прикреплены к OM с помощью N-концевого липидного хвоста, и другие интегральные белки OM, которые содержат области, пронизывающие мембраны (Bos and Tommassen, 2004).
ОМ участвует в большинстве специфических процессов распознавания, так как это наиболее уязвимая область бактериальной клетки.Поскольку в области OM существует относительно немного основных белков, ожидается, что эти белки будут важными антигенами для хозяина. Постулируется, что образование и поддержание пародонтальных биопленок связано с взаимодействием между пародонтальной микрофлорой, которое опосредуется белками OM (Bos et al., 2007). Имеются данные о том, что Т-хелперные клетки пациентов с агрессивным пародонтитом, активированные белками P. gingivalis OM, продуцируют более высокие уровни провоспалительных цитокинов, таких как IL-1β и IL-6, по сравнению со здоровыми контрольными людьми (Gonzales et al., 2014).
Анализ белков, экстрагированных из ОМ с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE), показал, что ОМ состоит из разнообразного набора белков размером от 20 до более 100 кДа. Наиболее часто встречающимися белками OM являются порины и OmpA-подобные белки (Bos et al., 2007). Однако до недавнего времени исследования основных белков OM в P. gingivalis оставались недостаточными из-за гидрофобной природы белков. Было сделано несколько попыток охарактеризовать белки OM с использованием различных методов солюбилизации (Yoshimura et al., 2009).
Одно из самых ранних исследований выполнено Yoshimura et al. (1989), в котором был успешно очищен главный ОМ-белок массой 75 кДа, существующий в виде высокомолекулярного олигомера. Этот белок был продемонстрирован Watanabe et al. (1992), чтобы стимулировать активацию поликлональных B-клеток и продукцию IL-1 из перитонеальных макрофагов мыши.
С другой стороны, Saito et al. (1997) сообщили, что ОМ-белок массой 40 кДа из P. gingivalis является важным фактором агрегации на поверхности клетки.В этом исследовании антитело против белка ингибировало активность агрегации клеток P. gingivalis по отношению к A. viscosus , которая является одним из пионеров колонизации поверхности зубов. Этот ОМ-белок массой 40 кДа обнаружен во многих штаммах P. gingivalis , располагаясь как на поверхности клетки, так и во внеклеточных пузырьках. Чрескожная иммунизация мышей ОМ-белком 40 кДа вызвала повышение уровня антител IgG, которые ингибировали коагрегацию P.gingivalis пузырьков (Maeba et al., 2005). В последние годы в исследованиях на животных моделях Zhang et al. (2009) и Liu et al. (2010) было продемонстрировано, что вакцинация мышей ОМ-белком 40 кДа из P. gingivalis вызывает значительное снижение потери альвеолярной кости.
ОМ-белок массой 40 кДа также является гемин-связывающим белком (Shibata et al., 2003). Между тем, назальная иммунизация с использованием белка OM 40 кДа плюс холерный токсин вызывает защитный иммунный ответ против P. gingivalis как у молодых, так и у старых мышей, помимо предотвращения атеросклероза (Koizumi et al., 2008; Cai et al., 2013). В совокупности результаты предполагают, что назальная доставка белка OM может быть потенциальной стратегией вакцины для обеспечения защитного иммунитета человека и, следовательно, профилактики пародонтита.
Кроме того, сравнивались профили белков OM P. gingivalis ATCC 33277 и W83, и было обнаружено, что оба штамма обладают большинством белков OM, таких как RagA, RagB и OmpA-подобных белков, с аналогичным характером распределения ( Имаи и др., 2005). Эти данные, полученные с помощью иммуноблоттинга, позволяют предположить, что эти белки OM представляют собой поверхностные иммунореактивные антигены, но перекрестно реагируют с другими P.gingivalis , должны быть приняты во внимание штаммы.
Согласно Chen et al. (2011) было обнаружено, что белок ОМ, LptO (PG0027) необходим для деацилирования O LPS P. gingivalis , и постулируется, что такое структурное образование необходимо для обеспечения прикрепления к клеткам-хозяевам. Он также играет важную роль в секреции гингипаина на поверхность клеток. С помощью синего нативного PAGE-анализа LptO был обнаружен в составе комплексов до семи различных размеров, и он взаимодействовал с другим белковым комплексом, PG0026, при секреции белков С-концевого домена (Glew et al., 2014; Сайки и Кониши, 2014). Кроме того, было обнаружено, что новый белок OM, названный PG534, играет важную роль в производстве активных гингипаинов (Saiki and Konishi, 2010). Активность гингипаинов R (RgpA и RgpB) и гингипаина K (Kgp) в P. gingivalis с дефектным белком PG534 была снижена по сравнению с его штаммом дикого типа.
Также проводятся исследования по ослаблению действия белков ОМ P. gingivalis . Например, исследования природных экстрактов растений, таких как полифенолы Myrothamnus flabellifolia , показали, что они снижают уровень P.gingivalis адгезия и инвазия до примерно 50% за счет взаимодействия с бактериальными белками ОМ. Такой антиадгезивный эффект также сопровождается цитопротекторным действием, связанным с секрецией цитокинов (Löhr et al., 2011). Однако следует отметить, что этот растительный экстракт был протестирован только на белках OM, но не на других компонентах вирулентности P. gingivalis .
Заключение
В совокупности P. gingivalis является основным этиологическим фактором развития хронического пародонтита.Было обнаружено, что этот вторичный колонизатор экспрессирует множество факторов вирулентности, участвующих в колонизации поддесневого налета и модуляции иммунных ответов клеток-хозяев. Чтобы увеличить выживаемость в организме хозяина, P. gingivalis способен локально вторгаться в ткань периондонта, тем самым избегая иммунного надзора, сохраняя при этом свою жизнеспособность. Каждый фактор вирулентности играет важную роль в препятствовании клеточно-опосредованному иммунному ответу хозяина. Тем не менее, несмотря на убедительные данные, представленные в этом исследовании, следует предупредить, что в реальной ситуации in vivo бактерии экспрессируют целый набор факторов вирулентности, которые могут взаимодействовать и стимулировать клетки-хозяева иначе, чем бактерии. единичный фактор вирулентности.Кроме того, заболевания пародонта редко возникают в результате действия отдельных бактерий. Следовательно, P. gingivalis , вероятно, будет работать с другой микробиотой полости рта, чтобы процветать в тяжелых воспалительных условиях в пародонтальном кармане.
На сегодняшний день было проведено множество исследований для выяснения механизма вирулентности соединений, секретируемых P. gingivalis , и клеточного взаимодействия с хозяином. Лучшее понимание взаимодействия между пародонтальными бактериями и клетками-хозяевами на молекулярном и клеточном уровне может в конечном итоге иметь отношение к общему благополучию хозяина.В последние годы использование натуральных соединений привлекло больше внимания для ослабления действия P. gingivalis . Натуральные продукты растительного происхождения широко используются в качестве терапевтических средств для регулирования взаимодействий между микроорганизмами. Одним из привлекательных терапевтических свойств является то, что биологически активные соединения растений безопасны и не должны вызывать токсичность по отношению к клеткам человека. Тем не менее, всесторонние исследования токсичности этих соединений по-прежнему считаются необходимыми.
Благодаря огромному прогрессу в биомедицинских исследованиях мы надеемся в конечном итоге выяснить возможный уникальный механизм действия P.gingivalis и его детерминанты вирулентности. Исследования в этой области помогут в разработке эффективных методов лечения бактериальной деструкции соединительной ткани. Эти терапевтические подходы могут быть важны в борьбе с хроническими инфекциями P. gingivalis , предотвращая рост и колонизацию P. gingivalis .
Вклад авторов
KH проанализировал литературу и написал статью, KS и KC отредактировали и одобрили рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантами на высокоэффективные исследования Университета Малайи (UM C / 625/1 / HIR / MOHE / CHAN / 01, A-000001-50001 и UM C / 625/1 / HIR / MOHE / CHAN / 14/1, H-50001-A000027) присужден KC.
Ссылки
- Aas J.А., Пастер Б. Дж., Стокс Л. Н., Олсен И., Дьюхерст Ф. Э. (2005). Определение нормальной бактериальной флоры полости рта. J. Clin. Microbiol. 43 год 5721–5732. 10.1128 / JCM.43.11.5721-5732.2005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Али Р. В., Велческу К., Дживанеску М. К., Лофтус Б., Скауг Н. (1996). Распространенность 6 предполагаемых патогенов пародонта в образцах поддесневого налета от взрослых пациентов с пародонтитом в Румынии. J. Clin. Пародонтол. 23 133–139.10.1111 / j.1600-051X.1996.tb00546.x [PubMed] [CrossRef] [Google Scholar]
- Али Т., Абидин К. З. (2012). Связь заболеваний пародонта с недоношенными новорожденными с низкой массой тела в выбранной популяции — проспективное исследование. Общественная вмятина. Здоровье 29 100–105. [PubMed] [Google Scholar]
- Аль-Кутуб М. Н., Брахам П. Х., Карими-Насер Л. М., Лю Х., Дженко К. А., Дарво Р. П. (2006). Гемин-зависимая модуляция структуры липида А липополисахарида Porphyromonas gingivalis . Заражение. Иммун. 74 4474–4485. 10.1128 / IAI.01924-05 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2007). Нарушение эпителиального барьера и нарушение клеточной функции Porphyromonas gingivalis . Фронт. Biosci. 12: 3965–3974. 10.2741 / 2363 [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2010). Бактериальные адгезии к компонентам хозяина при пародонтите. Пародонтология 2000 г. 12–37. 10.1111 / j.1600-0757.2009.00307.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Накагава И., Окахаши Н., Хамада Н. (2004). Вариации фимбрий Porphyromonas gingivalis в зависимости от микробного патогенеза. J. Пародонтология. Res. 39 136–142. 10.1111 / j.1600-0765.2004.00719.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Такеучи Х., Фурута Н. (2010). Везикулы наружной мембраны действуют как наступательное оружие во взаимодействиях паразит-хозяин. Microbes Infect. 12 791–798.10.1016 / j.micinf.2010.05.008 [PubMed] [CrossRef] [Google Scholar]
- Андриан Э., Гренье Д., Руабиа М. (2004). Модели проникновения и разрушения тканей in vitro с помощью Porphyromonas gingivalis . Заражение. Иммун. 72 4689–4698. 10.1128 / IAI.72.8.4689-4698.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Азельмат Дж., Ларенте Дж. Ф., Гренье Д. (2015). Антрахиноновый реин проявляет синергетическую антибактериальную активность в сочетании с метронидазолом или природными соединениями и снижает экспрессию гена вирулентности в Porphyromonas gingivalis . Arch. Oral Biol. 60 342–346. 10.1016 / j.archoralbio.2014.11.006 [PubMed] [CrossRef] [Google Scholar]
- Бэк К. Дж., Джи С., Ким И. С., Чой Ю. (2015). Связь инвазионной способности Porphyromonas gingivalis с тяжестью пародонтита. Вирулентность 6 274–281. 10.1080 / 21505594.2014.1000764 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бейнбридж Б. В., Хирано Т., Гришабер Н., Дэйви М. Э. (2015). Удаление инвертированного повторяющегося элемента из 77 пар оснований изменяет синтез поверхностных полисахаридов в Porphyromonas gingivalis . J. Bacteriol. 197 1208–1220. 10.1128 / JB.02589-14 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bao K., Belibasakis GN, Thurnheer T., Aduse-Opoku J., Curtis MA, Bostanci N. (2014) . Роль Porphyromonas gingivalis gingipains в формировании многовидовых биопленок. BMC Microbiol. 14: 258 10.1186 / s12866-014-0258-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бартольд П. М., Нараянан А. С. (2006). Молекулярная и клеточная биология здоровых и больных тканей пародонта. Пародонтология 2000 г. 29–49. 10.1111 / j.1600-0757.2005.00140.x [PubMed] [CrossRef] [Google Scholar]
- Бек Дж., Гарсия Р., Хейсс Г., Воконас П. С., Оффенбахер С. (1996). Заболевания пародонта и сердечно-сосудистые заболевания. J. Periodontol. 67 1123–1137. 10.1902 / jop.1996.67.10.1123 [PubMed] [CrossRef] [Google Scholar]
- Белибасакис Г. Н., Бостанси Н., Редди Д. (2010). Регулирование экспрессии активируемого протеазой рецептора-2 в фибробластах десен и Т-клетках Jurkat с помощью Porphyromonas gingivalis . Cell Biol. Int. 34
287–292. 10.1042 / CBI200
[PubMed] [CrossRef] [Google Scholar]
- Боде К., Чандад Ф., Гренье Д. (2006). [Патогенный потенциал Porphyromonas gingivalis, Treponema denticola и Tannerella forsythia , красного бактериального комплекса, связанного с пародонтитом]. Патол.-биол. 55 154–162. 10.1016 / j.patbio.2006.07.045 [PubMed] [CrossRef] [Google Scholar]
- Бос М. П., Роберт В., Томмассен Дж. (2007). Биогенез внешней мембраны грамотрицательных бактерий. Annu. Rev. Microbiol. 61 191–214. 10.1146 / annurev.micro.61.080706.0 [PubMed] [CrossRef] [Google Scholar]
- Bos M. P., Tommassen J. (2004). Биогенез внешней мембраны грамотрицательных бактерий. Curr. Opin. Microbiol. 7 610–616. 10.1016 / j.mib.2004.10.011 [PubMed] [CrossRef] [Google Scholar]
- Бостанци Н., Белибасакис Г. Н. (2012). Porphyromonas gingivalis : инвазивный и ускользающий оппортунистический оральный патоген. FEMS Microbiol.Lett. 333 1–9. 10.1111 / j.1574-6968.2012.02579.x [PubMed] [CrossRef] [Google Scholar]
- Бостанси Н., Турнхеер Т., Адусе-Опоку Дж., Кертис М. А., Зинкернагель А. С., Белибасакис Г. Н. (2013). Porphyromonas gingivalis регулирует TREM-1 в полиморфно-ядерных нейтрофилах человека через гингипаины. PLoS ONE 8: e75784 10.1371 / journal.pone.0075784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бруннер Дж., Шерес Н., Эль Идрисси Н. Б., Дэн Д.М., Лайне М. Л., ван Винкельхофф А. Дж. И др. (2010). Капсула Porphyromonas gingivalis снижает иммунный ответ фибробластов десен человека. BMC Microbiol. 10: 5 10.1186 / 1471-2180-10-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Cai Y., Kurita-Ochiai T., Kobayashi R., Hashizume T., Yamamoto M. (2013) . Назальная иммунизация белком внешней мембраны 40 кДа Porphyromonas gingivalis плюс холерный токсин индуцирует защитный иммунитет у старых мышей. J. Oral Sci. 55 107–114. 10.2334 / josnusd.55.107 [PubMed] [CrossRef] [Google Scholar]
- Касарин Р. К., Дель Пелосо Рибейро Э., Мариано Ф. С., Носити Ф. Х., младший, Казати М. З., Гонсалвес Р. Б. (2010). Уровни Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis , воспалительных цитокинов и видоспецифического иммуноглобулина G при генерализованном агрессивном и хроническом пародонтите. J. Periodont. Res. 45 635–642. 10.1111 / j.1600-0765.2010.01278.x [PubMed] [CrossRef] [Google Scholar]
- Чен Ю., Пэн Б., Ян К., Глю М. Д., Вейт П. Д., Кросс К. Дж. и др. (2011). Белок внешней мембраны LptO необходим для O-деацилирования LPS и координированной секреции и прикрепления белков A-LPS и CTD в Porphyromonas gingivalis . Мол. Microbiol. 79 1380–1401. 10.1111 / j.1365-2958.2010.07530.x [PubMed] [CrossRef] [Google Scholar]
- Ci X., Chen L., Ou X. (2015). Экстракты проантоцианидинов виноградных косточек ингибируют липополисахарид Porphyromonas gingivalis . Shanghai J. Stomatol. 24 433–436. [PubMed] [Google Scholar]
- Curtis M., Aduse-Opoku J., Rangarajan M. (2001). Цистеиновые протеазы Porphyromonas gingivalis . Crit. Rev. Oral Biol. Med. 12 192–216. 10.1177 / 10454411010120030101 [PubMed] [CrossRef] [Google Scholar]
- Дарво Р. П., Белтон К. М., Райф Р. А., Ламонт Р. Дж. (1998). Местный хемокиновый паралич, новый патогенетический механизм Porphyromonas gingivalis . Заражение.Иммун. 66 1660–1665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Дарво Р. П., Фам Т.-Т. Т., Лемли К., Райфе Р. А., Бейнбридж Б. В., Коутс С. Р. и др. (2004). Porphyromonas gingivalis липополисахарид содержит несколько видов липидов A, которые функционально взаимодействуют с обоими toll-подобными рецепторами 2 и 4. Заражение. Иммун. 72 5041–5051. 10.1128 / IAI.72.9.5041-5051.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Датта Х. К., Нг В. Ф., Уокер Дж. А., Так С. П., Варанаси С. С. (2008). Клеточная биология костного метаболизма. J. Clin. Патол. 61 577–587. 10.1136 / jcp.2007.048868 [PubMed] [CrossRef] [Google Scholar]
- de Diego I., Veillard F., Sztukowska M. N., Guevara T., Potempa B., Pomowski A., et al. (2014). Структура и механизм цистеинпептидазы Gingipain K (Kgp), основного фактора вирулентности Porphyromonas gingivalis при пародонтите. J. Biol. Chem. 289 32291–32302.10.1074 / jbc.M114.602052 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- ДеЛеон-Пеннелл К. Ю., де Кастро Брас Л. Э., Линдси М. Л. (2013). Циркулирующий липополисахарид Porphyromonas gingivalis сбрасывает сердечный гомеостаз у мышей посредством механизма, зависимого от матриксной металлопротеиназы-9. Physiol. Репутация 1: e00079 10.1002 / phy2.79 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дерраджиа А., Аланази Х., Пак Х. Дж., Джериби Р., Семлали А., Руабия М. (2015). α-токоферол снижает уровень интерлейкинов-1β и -6 и увеличивает секрецию β-дефенсинов-1 и -2 человека в фибробластах десен человека, стимулированных липополисахаридом Porphyromonas gingivalis . J. Periodontal Res. 10.1111 / jre.12308 [Epub перед печатью]. [PubMed] [CrossRef] [Google Scholar]
- Диас Л., Хоар А., Сото К., Бугеньо И., Сильва Н., Дутзан Н. и др. (2015). Изменения липополисахаридного профиля клинических изолятов Porphyromonas gingivalis коррелируют с изменениями морфологии колоний и устойчивости к полимиксину B. Анаэроб 33 25–32. 10.1016 / j.anaerobe.2015.01.009 [PubMed] [CrossRef] [Google Scholar]
- Dierickx K., Pauwels M., Laine M. L., Van Eldere J., Cassiman J. J., van Winkelhoff A. J. и др. (2003). Адгезия серотипов Porphyromonas gingivalis к эпителию кармана. J. Periodontol. 74 844–848. 10.1902 / jop.2003.74.6.844 [PubMed] [CrossRef] [Google Scholar]
- Дорн Б. Р., Беркс Дж. Н., Зейферт К. Н., Прогульске-Фокс А. (2000). Инвазия эндотелиальных и эпителиальных клеток штаммом Porphyromonas gingivalis . FEMS Microbiol. Lett. 187 139–144. 10.1111 / j.1574-6968.2000.tb09150.x [PubMed] [CrossRef] [Google Scholar]
- Dubin G., Koziel J., Pyrc K., Wladyka B., Potempa J. (2013). Бактериальные протеазы в заболевании — роль во внутриклеточном выживании, уклонении от свертывания / фибринолиза, врожденных защитных сил, токсикозов и вирусных инфекций. Curr. Pharm. Des. 19 1090–1113. 10.2174 / 13816128113111 [PubMed] [CrossRef] [Google Scholar]
- Элоэ-Фадрош Э. А., Раско Д. А. (2013).Микробиом человека: от симбиоза к патогенезу. Annu. Rev. Med. 64 145–163. 10.1146 / annurev-med-010312-133513 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Friedewald V. E., Kornman K. S., Beck J. D., Genco R., Goldfine A., Libby P., et al. (2009). Американский кардиологический журнал и консенсус редакторов журнала пародонтологии: пародонтит и атеросклеротическое сердечно-сосудистое заболевание. Am. J. Cardiol. 104 59–68. 10.1016 / j.amjcard.2009.05.002 [PubMed] [CrossRef] [Google Scholar]
- Fujiwara T., Morishima S., Takahashi I., Hamada S. (1993). Молекулярное клонирование и секвенирование гена фимбрилина штаммов Porphyromonas gingivalis и характеристика рекомбинантных белков. Biochem. Биофиз. Res. Commun. 197 241–247. 10.1006 / bbrc.1993.2467 [PubMed] [CrossRef] [Google Scholar]
- Дженко Р. Дж., Боргнакке В. С. (2013). Факторы риска заболеваний пародонта. Пародонтология 2000 г. 59–94.10.1111 / j.1600-0757.2012.00457.x [PubMed] [CrossRef] [Google Scholar]
- Glew M. D., Veith P. D., Chen D., Seers C. A., Chen Y.-Y., Reynolds E. C. (2014). Голубой нативный ПААГ-анализ комплексов мембранных белков в Porphyromonas gingivalis . J. Proteomics 110 72–92. 10.1016 / j.jprot.2014.07.033 [PubMed] [CrossRef] [Google Scholar]
- Гокю М., Кобаяши Х., Нанбара Х., Судо Т., Икеда Й., Суда Т. и др. (2014). Продукция тромбоспондина-1 усиливается липополисахаридом Porphyromonas gingivalis в клетках THP-1. PLoS ONE 9: e115107 10.1371 / journal.pone.0115107 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzales J., Groeger S., Johansson A., Meyle J. (2014). Т-хелперы от пациентов с агрессивным пародонтитом производят более высокие уровни интерлейкина-1 бета и интерлейкина-6 во взаимодействии с Porphyromonas gingivalis . Clin. Устное расследование. 18 1835–1843 гг. 10.1007 / s00784-013-1162-5 [PubMed] [CrossRef] [Google Scholar]
- Haffajee A. D., Сокранский С.С. (1994). Микробные этиологические агенты деструктивных заболеваний пародонта. Пародонтология 2000 г. 78–111. 10.1111 / j.1600-0757.1994.tb00020.x [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Абэ Т., Маэкава Т., Хаджишенгаллис Э., Ламбрис Дж. Д. (2013). Роль комплемента в гомеостазе пародонта микробами-хозяевами. Семин. Иммунол. (Эльзевьер) 25 65–72. 10.1016 / j.smim.2013.04.004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Дарво Р. П., Кертис М. А. (2012). Гипотеза краеугольного камня. Nat. Rev. Microbiol. 10 717–725. 10.1038 / nrmicro2873 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Ламонт Р. Дж. (2014). Во все тяжкие: манипулирование реакцией хозяина с помощью Porphyromonas gingivalis . Eur. J. Immunol. 44 год 328–338. 10.1002 / eji.201344202 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Wang M., Liang S., Триантафилу М., Триантафилу К. (2008). Патогенетическая индукция перекрестных помех CXCR4 / TLR2 нарушает защитную функцию хозяина. Proc. Natl. Акад. Sci. США 105 13532–13537. 10.1073 / pnas.0803852105 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хамада Н., Ватанабе К., Сасакава К., Йошикава М., Йошимура Ф., Умемото Т. (1994). Конструирование и характеристика мутанта fimA Porphyromonas gingivalis . Заражение. Иммун. 62 1696–1704. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hamedi M., Белибасакис Г., Кручли А., Рангараджан М., Кертис М., Бостанси Н. (2009). Porphyromonas gingivalis Супернатанты культур по-разному регулируют интерлейкин-1β и интерлейкин-18 в моноцитарных клетках человека. Цитокин 45 99–104. 10.1016 / j.cyto.2008.11.005 [PubMed] [CrossRef] [Google Scholar]
- Хэндли П. С., Типлер Л. С. (1986). Исследование поверхностных структур и гидрофобности оральных и неоральных видов бактерий рода Bacteroides под электронным микроскопом. Arch. Oral Biol. 31 год 325–335. 10.1016 / 0003-9969 (86) -6 [PubMed] [CrossRef] [Google Scholar]
- Харагути А., Миура М., Фудзисе О., Хамачи Т., Нисимура Ф. (2014). Porphyromonas gingivalis гингипаин участвует в отслоении и агрегации биопленки Aggregatibacter actinomycetemcomitans . Мол. Oral Microbiol. 29 131–143. 10.1111 / omi.12051 [PubMed] [CrossRef] [Google Scholar]
- Хаяси С., Ямада Х., Фукуи М., Ито Х.-О., Сата М. (2015). Корреляция между артериосклерозом и состоянием пародонта, оцениваемая по уровням лактоферрина и α1-антитрипсина в десневой щелевой жидкости. Внутр. Сердце J. 56 639–643. 10.1536 / ihj.15-218 [PubMed] [CrossRef] [Google Scholar]
- Херат Т. Д. К., Ван Й., Сеневиратн К. Дж., Дарво Р. П., Ван С. Й., Джин Л. Дж. (2011). Гетерогенный LPS Porphyromonas gingivalis по-разному модулирует врожденный иммунный ответ десны человека. BMC Proc. 5:86 10.1186 / 1753-6561-5-s1-p86 [CrossRef] [Google Scholar]
- Herzberg M. C., Meyer M. W. (1996). Влияние флоры полости рта на тромбоциты: возможные последствия при сердечно-сосудистых заболеваниях. J. Periodontol. 67 1138–1142. 10.1902 / jop.1996.67.10s.1138 [PubMed] [CrossRef] [Google Scholar]
- Холт С. К., Кесавалу Л., Уокер С., Дженко К. А. (1999). Факторы вирулентности Porphyromonas gingivalis . Пародонтология 2000 г. 168–238. 10.1111 / j.1600-0757.1999.tb00162.x [PubMed] [CrossRef] [Google Scholar]
- Игбоин К. О., Тордофф К. П., Мешбергер М. Л., Гриффен А. Л., Лейс Э. Дж. (2011). Porphyromonas gingivalis -хостовые взаимодействия в модели Drosophila melanogaster . Заражение. Иммун. 79 449–458. 10.1128 / IAI.00785-10 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Имаи М., Мураками Ю., Нагано К., Накамура Х., Йошимура Ф. (2005). Основные белки внешней мембраны из Porphyromonas gingivalis : изменение штамма, распределение и клиническое значение при перирадикулярных поражениях. Eur. J. Oral Sci. 113 391–399. 10.1111 / j.1600-0722.2005.00235.x [PubMed] [CrossRef] [Google Scholar]
- Имамура Т., Трэвис Дж., Потемпа Дж. (2003). Двухфазная вирулентная активность гингипаинов: активация и инактивация белков хозяина. Curr. Protein Pept. Sci. 4
443–450. 10.2174 / 138
33487027 [PubMed] [CrossRef] [Google Scholar]
- Иршад М., ван дер Рейден В. А., Крилаард В., Лейн М. Л. (2012). Инвазия и выживаемость Porphyromonas gingivalis in vitro в фибробластах десен; роль капсулы. Arch. Иммунол. Ther. Exp. 60 469–476. 10.1007 / s00005-012-0196-8 [PubMed] [CrossRef] [Google Scholar]
- Джейн С., Дарво Р. П. (2010). Вклад липополисахарида Porphyromonas gingivalis в пародонтит. Пародонтология 2000 г. 53–70. 10.1111 / j.1600-0757.2009.00333.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дженкинсон Х. Ф., Ламонт Р. Дж. (2006). «Микробная экология полости рта», в Микробиология и иммунология полости рта редакторы Ламонт Р.Дж., Берн Р. А., Ланц М. С., Леблан Д. Дж. (Вашингтон, округ Колумбия: ASM Press;). [Google Scholar]
- Jian C.-X., Li M.-Z., Zheng W.-Y., He Y., Ren Y., Wu Z.-M., et al. (2015). Торментиновая кислота подавляет LPS-индуцированный воспалительный ответ в фибробластах десен человека посредством ингибирования TLR4-опосредованного сигнального пути NF-κB и MAPKs. Arch. Oral Biol. 60 1327–1332. 10.1016 / j.archoralbio.2015.05.005 [PubMed] [CrossRef] [Google Scholar]
- Катаока С., Баба А., Суда Ю., Такий Р., Хашимото М., Кавакубо Т. и др. (2014). Новый мощный двойной ингибитор аргингипаинов и лизингипаинов в качестве многообещающего средства для лечения заболеваний пародонта. FASEB J. 28 год 3564–3578. 10.1096 / fj.14-252130 [PubMed] [CrossRef] [Google Scholar]
- Като Х., Тагучи Ю., Томинага К., Умеда М., Танака А. (2014). Porphyromonas gingivalis LPS подавляет дифференцировку остеобластов и способствует выработке провоспалительных цитокинов в стволовых клетках пародонтальной связки человека. Arch. Oral Biol. 59 167–175. 10.1016 / j.archoralbio.2013.11.008 [PubMed] [CrossRef] [Google Scholar]
- Кац Дж., Уорд Д., Михалек С. (1996). Влияние ответов хозяина на патогенность штаммов Porphyromonas gingivalis . Oral Microbiol. Иммунол. 11 309–318. 10.1111 / j.1399-302X.1996.tb00187.x [PubMed] [CrossRef] [Google Scholar]
- Коидзуми Ю., Курита-Очиаи Т., Огучи С., Ямамото М. (2008). Назальная иммунизация белком внешней мембраны Porphyromonas gingivalis снижает количество P.gingivalis -индуцированный атеросклероз и воспаление у мышей со спонтанной гиперлипидемией. Заражение. Иммун. 76 2958–2965. 10.1128 / IAI.01572-07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Komatsu T. (2014). «Окислительный стресс и заболевания пародонта при синдроме Дауна», в Исследования заболеваний пародонта редакторы Экуни Д., Баттино М., Томофуджи Т., Путнинс Э. Э. (Берлин: Springer;) 211–223. [Google Scholar]
- Kong L., Qi X., Huang S., Chen S., Ву Ю., Чжао Л. (2015). Теафлавины подавляют патогенные свойства P. gingivalis и продукцию ММП в P. gingivalis -стимулированных фибробластах десен человека. Arch. Oral Biol. 60 12–22. 10.1016 / j.archoralbio.2014.08.019 [PubMed] [CrossRef] [Google Scholar]
- Кристофферсен А. К., Солли С. Дж., Нгуен Т. Д., Энерсен М. (2015). Ассоциация генотипа гингипаина rgpB с генотипом основных фимбрий (fimA) в клинических изолятах пародонтального патогена Porphyromonas gingivalis . J. Oral Microbiol. 7: 29124 10.3402 / jom.v7.29124 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kuramitsu H. K., Qi M., Kang I.-C., Chen W. (2001). Роль пародонтальных бактерий в сердечно-сосудистых заболеваниях. Ann. Пародонтол. 6 41–47. 10.1902 / annals.2001.6.1.41 [PubMed] [CrossRef] [Google Scholar]
- Лейн М. Л., Аппельмелк Б. Дж., Ван Винкельхофф А. Дж. (1997). Распространенность и распределение шести капсульных серотипов Porphyromonas gingivalis у пациентов с пародонтитом. J. Dent. Res. 76 1840–1844 гг. 10.1177 / 00220345970760120601 [PubMed] [CrossRef] [Google Scholar]
- Ли Дж. Й., Соджар Х. Т., Беди Г. С., Дженко Р. Дж. (1992). Синтетические пептиды, аналогичные последовательности фимбриллина, ингибируют адгезию Porphyromonas gingivalis . Заражение. Иммун. 60 1662–1670. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лю К., Хашизуме Т., Курита-Очиай Т., Фуджихаши К., Ямамото М. (2010). Оральная иммунизация с использованием белка внешней мембраны Porphyromonas gingivalis и CpGoligodeoxynucleotides вырабатывает цитокины T-хелперов 1 и 2 для усиления защитного иммунитета. Мол. Oral Microbiol. 25 178–189. 10.1111 / j.2041-1014.2009.00560.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Лю Р., Деста Т., Раптис М., Дарво Р. П., Грейвс Д. Т. (2008). Липополисахариды P. gingivalis и E. coli демонстрируют разную системную, но схожую локальную индукцию маркеров воспаления. J. Periodontol. 79 1241–1247. 10.1902 / jop.2008.070575 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lockhart P.Б., Болджер А. Ф., Папапану П. Н., Осинбовале О., Тревизан М., Левисон М. Э. и др. (2012). Заболевания пародонта и атеросклеротическое заболевание сосудов: подтверждают ли данные независимую связь? Научное заявление Американской кардиологической ассоциации. Тираж 125 2520–2544. 10.1161 / CIR.0b013e31825719f3 [PubMed] [CrossRef] [Google Scholar]
- Лёр Г., Бейклер Т., Подбельски А., Стандарт К., Реданц С., Хенсель А. (2011). Полифенолы Myrothamnus flabellifolia Welw.подавляют адгезию in vitro Porphyromonas gingivalis и оказывают противовоспалительное цитопротекторное действие на клетки KB. J. Clin. Пародонтол. 38 457–469. 10.1111 / j.1600-051X.2010.01654.x [PubMed] [CrossRef] [Google Scholar]
- Мадианос П. Н., Бобетсис Ю. А., Оффенбахер С. (2013). Неблагоприятные исходы беременности (АПО) и заболевания пародонта: патогенетические механизмы. J. Clin. Пародонтол. 40 S170 – S180. 10.1111 / jcpe.12082 [PubMed] [CrossRef] [Google Scholar]
- Maeba S., Отаке С., Намикоши Дж., Сибата Ю., Хаякава М., Абико Ю. и др. (2005). Чрескожная иммунизация 40 кДа белком внешней мембраны Porphyromonas gingivalis индуцирует специфические антитела, которые ингибируют коагрегацию с помощью P. gingivalis . Вакцина 23 2513–2521. 10.1016 / j.vaccine.2004.10.036 [PubMed] [CrossRef] [Google Scholar]
- Маэда К., Триббл Г. Д., Такер К. М., Аная К., Сидзукуиси С., Льюис Дж. П. и др. (2008). Тирозинфосфатаза Porphyromonas gingivalis является многофункциональным регулятором признаков вирулентности. Мол. Microbiol. 69 1153–1164. 10.1111 / j.1365-2958.2008.06338.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Maekawa T., Krauss JL, Abe T., Jotwani R., Triantafilou M., Triantafilou K. , и другие. (2014). Porphyromonas gingivalis манипулирует передачей сигналов комплемента и TLR, чтобы отделить бактериальный клиренс от воспаления и способствовать дисбактериозу. Клеточный микроб-хозяин 15 768–778. 10.1016 / j.chom.2014.05.012 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mahanonda R., Сеймур Г. Дж., Пауэлл Л. В., Гуд М. Ф., Холлидей Дж. У. (1991). Влияние начального лечения хронического воспалительного заболевания пародонта на частоту Т-лимфоцитов периферической крови, специфичных для пародонтопатических бактерий. Oral Microbiol. Иммунол. 6 221–227. 10.1111 / j.1399-302X.1991.tb00481.x [PubMed] [CrossRef] [Google Scholar]
- Maiden M. F., Cohee P., Tanner A. C. (2003). Предложение сохранить форму прилагательного специфического эпитета при реклассификации Bacteroides forsythus Tanner et al .1986 к роду Tannerella Sakamoto et al . 2002 как Tannerella forsythia corrig., Gen. ноя, гребешок. ноя Запрос заключения. Внутр. J. Syst. Evol. Microbiol. 53 2111–2112. 10.1099 / ijs.0.02641-0 [PubMed] [CrossRef] [Google Scholar]
- Мантри К. К., Чен К. Х., Дон Х., Гудвин Дж. С., Пратап С., Паромов В. и др. (2015). Фимбрии-опосредованное образование пузырьков внешней мембраны и инвазия Porphyromonas gingivalis . Microbiologyopen 4 53–65.10.1002 / mbo3.221 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Marcotte H., Lavoie M. C. (1998). Микробная экология полости рта и роль иммуноглобулина слюны A. Microbiol. Мол. Биол. Сборка 62 71–109. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Марес К. Дж., Хеллвард А., Срока А., Адамович К., Белецкая Е., Козиль Дж. И др. (2013). Porphyromonas gingivalis способствует развитию и прогрессированию деструктивного артрита благодаря своей уникальной бактериальной пептидиларгининдезиминазе (PAD). PLoS Pathog. 9: e1003627 10.1371 / journal.ppat.1003627 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mehta A. (2015). Факторы риска, связанные с заболеваниями пародонта, и их клинические аспекты. Внутр. J. Contemp. Вмятина. Med. Сборка 2015 г. 1–15. [Google Scholar]
- Мур У. Э., Мур Л. Х., Рэнни Р., Смиберт Р. М., Бурмейстер Дж. А., Шенкейн Х. А. (1991). Микрофлора участков пародонта показывает активную деструктивную прогрессию. Дж.Clin. Пародонтол. 18 729–739. 10.1111 / j.1600-051X.1991.tb00064.x [PubMed] [CrossRef] [Google Scholar]
- Мур У. Э., Мур Л. В. (1994). Бактерии заболеваний пародонта. Пародонтология 2000 г. 66–77. 10.1111 / j.1600-0757.1994.tb00019.x [PubMed] [CrossRef] [Google Scholar]
- Мураками Ю., Кавата А., Ито С., Катаяма Т., Фудзисава С. (2015). Активность по улавливанию радикалов и цитотоксичность ресвератрола, орцинола и 4-аллилфенола и их ингибирующие эффекты на экспрессию гена cox-2 и активацию Nf-κb в RAW264.7 клеток стимулировали Porphyromonas gingivalis -fimbriae. In Vivo 29 341–349. [PubMed] [Google Scholar]
- На Х., Лим Э., Чон С., Рю М., Пак М., Чунг Дж. (2014). Экспрессия ингибитора активатора плазминогена типа 1, индуцированная липополисахаридом Porphyromonas gingivalis в фибробласте десны человека. J. Microbiol. 52 154–160. 10.1007 / s12275-014-3022-7 [PubMed] [CrossRef] [Google Scholar]
- Nagano K., Hasegawa Y., Yoshida Y., Йошимура Ф. (2015). Главный фимбрилиновый вариант фимбрий Mfa1 в Porphyromonas gingivalis . J. Dent. Res. 94 1143–1148. 10.1177 / 0022034515588275 [PubMed] [CrossRef] [Google Scholar]
- Накано К., Инаба Х., Номура Р., Немото Х., Такеда М., Йошиока Х. и др. (2006). Обнаружение кариесогенного Streptococcus mutans в образцах экстирпированного сердечного клапана и атероматозных бляшек. J. Clin. Microbiol. 44 год 3313–3317. 10.1128 / JCM.00377-06 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Nikaido H.(2003). Пересмотр молекулярных основ проницаемости бактериальной внешней мембраны. Microbiol. Мол. Биол. Сборка 67 593–656. 10.1128 / MMBR.67.4.593-656.2003 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Нисенгард Р. Дж., Ньюман М. Г. (1994). Oral Microbiol Immunol. Филадельфия: W.B. Компания Сондерс. [Google Scholar]
- Оффенбахер С. (1996). Заболевания пародонта: патогенез. Ann. Пародонтол. 1 821–878. 10.1902 / annals.1996.1.1.821 [PubMed] [CrossRef] [Google Scholar]
- Огава Т., Яги Т. (2010). Биоактивный механизм липида A Porphyromonas gingivalis . Пародонтология 2000 г. 71–77. 10.1111 / j.1600-0757.2009.00343.x [PubMed] [CrossRef] [Google Scholar]
- Оливейра Ф. А. Ф., Форте С. П. Ф., Сильва П. Г., Лопес С. Б., Черногория Р. К., Сантос А. К. и др. (2015). Молекулярный анализ бактерий полости рта в сердечном клапане пациентов с сердечно-сосудистыми заболеваниями с помощью полимеразной цепной реакции в реальном времени. Медицина 94: e2067 10.1097 / MD.0000000000002067 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Парахитиява Н.Б., Скалли К., Люнг В. К., Ям В. К., Джин Л. Дж., Самаранаяке Л. П. (2010). Изучение бактериальной флоры полости рта: текущее состояние и будущие направления. Устный дис. 16 136–145. 10.1111 / j.1601-0825.2009.01607.x [PubMed] [CrossRef] [Google Scholar]
- Пастер Б. Дж., Олсен И., Аас Дж. А., Дьюхерст Ф. Э. (2006). Широта бактериального разнообразия в пародонтальном кармане человека и других участках полости рта. Пародонтология 2000 г. 80–87. 10.1111 / j.1600-0757.2006.00174.x [PubMed] [CrossRef] [Google Scholar]
- Pennisi E.(2005). Полный рот микробов. Наука 307 1899–1901. 10.1126 / science.307.5717.1899 [PubMed] [CrossRef] [Google Scholar]
- Петерсен П. Э., Огава Х. (2012). Глобальное бремя заболеваний пародонта: к интеграции с профилактикой хронических заболеваний и борьбой с ними. Пародонтология 2000 г. 15–39. 10.1111 / j.1600-0757.2011.00425.x [PubMed] [CrossRef] [Google Scholar]
- Potempa J., Banbula A., Travis J. (2000). Роль бактериальных протеиназ в разрушении матрикса и модуляции ответов хозяина. Пародонтология 2000 г. 153–192. 10.1034 / j.1600-0757.2000.2240108.x [PubMed] [CrossRef] [Google Scholar]
- Приядаршини Р., Куджини К., Арндт А., Чен Т., Тьокро Н. О., Гудман С. Д. и др. (2013). Связанный с нуклеоидом белок HUβ влияет на глобальную экспрессию генов у Porphyromonas gingivalis . Микробиология 159 219–229. 10.1099 / mic.0.061002-0 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Розен Г., Села М. Н. (2006). Коагрегация Porphyromonas gingivalis и Fusobacterium nucleatum PK 1594 опосредуется капсульным полисахаридом и липополисахаридом. FEMS Microbiol. Lett. 256 304–310. 10.1111 / j.1574-6968.2006.00131.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2010). Идентификация нового белка внешней мембраны Porphyromonas gingivalis , PG534, необходимого для производства активных гингипаинов. FEMS Microbiol. Lett. 310 168–174. 10.1111 / j.1574-6968.2010.02059.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2014). Porphyromonas gingivalis C-концевая сигнальная пептидаза PG0026 и HagA взаимодействуют с белком внешней мембраны PG27 / LptO. Мол. Oral Microbiol. 29 32–44. 10.1111 / omi.12043 [PubMed] [CrossRef] [Google Scholar]
- Сайто С., Хирацука К., Хаякава М., Такигучи Х., Абико Ю. (1997). Ингибирование колонизирующего фактора Porphyromonas gingivalis между Actinomyces viscosus ATCC 19246 с помощью моноклональных антител против рекомбинантного белка внешней мембраны 40 кДа. Gen. Pharmacol. 28 год 675–680. 10.1016 / S0306-3623 (96) 00366-7 [PubMed] [CrossRef] [Google Scholar]
- Сареми А., Нельсон Р. Г., Таллох-Рид М., Хэнсон Р. Л., Сиверс М. Л., Тейлор Г. В. и др. (2005). Заболевания пародонта и смертность при диабете 2 типа. Уход за диабетом 28 год 27–32. 10.2337 / diacare.28.1.27 [PubMed] [CrossRef] [Google Scholar]
- Шмидт Дж., Йенч Х., Стингу К.-С., Сак У. (2014). Общий иммунный статус и микробиология полости рта у пациентов с различными формами пародонтита и здоровых лиц контрольной группы. PLoS ONE 9: e109187 10.1371 / journal.pone.0109187 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шах Х.Н., Коллинз М. Д. (1988). Предложение о реклассификации Bacteroides asaccharolyticus, Bacteroides gingivalis и Bacteroides endodontalis в новый род, Porphyromonas . Внутр. J. Sys. Бактериол. 38 128–131. 10.1099 / 00207713-38-1-128 [CrossRef] [Google Scholar]
- Sharma A., Sojar H. T., Lee J. Y., Genco R.J. (1993). Экспрессия функционального полипептида фимбриллина Porphyromonas gingivalis в Escherichia coli : очистка, физико-химическая и иммунохимическая характеристика и характеристики связывания. Заражение. Иммун. 61 3570–3573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шибата Ю., Хирацука К., Хаякава М., Широза Т., Такигучи Х., Нагацука Ю. и др. (2003). Фактор коагрегации 35 кДа представляет собой гемин-связывающий белок в Porphyromonas gingivalis . Biochem. Биофиз. Res. Commun. 300 351–356. 10.1016 / S0006-291X (02) 02826-7 [PubMed] [CrossRef] [Google Scholar]
- Silhavy T. J., Kahne D., Walker S. (2010). Оболочка бактериальной клетки. Cold Spring Harb. Перспектива. Биол. 2: a000414 10.1101 / cshperspect.a000414 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Singh A., Wyant T., Anaya-Bergman C., Aduse-Opoku J., Brunner J., Laine ML, et. al. (2011). Капсула Porphyromonas gingivalis приводит к снижению воспалительной реакции хозяина, уклонению от фагоцитоза и увеличению вирулентности. Заражение. Иммун. 79 4533–4542. 10.1128 / IAI.05016-11 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Slots J., Брэгд Л., Викстром М., Дален Г. (1986). Встречаемость Actinobacillus actinomycetemcomitans, Bacteroides gingivalis и Bacteroides intermediateus при деструктивных заболеваниях пародонта у взрослых. J. Clin. Пародонтол. 13 570–577. 10.1111 / j.1600-051X.1986.tb00849.x [PubMed] [CrossRef] [Google Scholar]
- Срока А., Штуковска М., Потемпа Дж., Трэвис Дж., Дженко К. А. (2001). Расщепление гемовых белков хозяина лизин- и аргинин-специфическими цистеиновыми протеиназами (гингипаинами) Porphyromonas gingivalis . J. Bacteriol. 183 5609–5616. 10.1128 / JB.183.19.5609-5616.2001 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Таннер А. К., Хаффер К., Браттхолл Г. Т., Висконти Р. А., Сокранский С. С. (1979). Исследование бактерий, вызывающих прогрессирование пародонтита у человека. J. Clin. Пародонтол. 6 278–307. 10.1111 / j.1600-051X.1979.tb01931.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1986). Неспецифическая теория микробной этиологии воспалительных заболеваний пародонта. J. Clin. Пародонтол. 13 905–911. 10.1111 / j.1600-051X.1986.tb01425.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1990). Факторы, контролирующие микрофлору здорового рта человека. Бока-Ратон, Флорида: CRC Press. [Google Scholar]
- Тьокро Н. О., Рокко К. Дж., Приядаршини Р., Дэйви М. Э., Гудман С. Д. (2014). Биохимический анализ взаимодействия белка Porphyromonas gingivalis HU PG0121 с ДНК. PLoS ONE 9: e
10.1371 / journal.pone.00
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Трэвис Дж., Пайк Р., Имамура Т., Потемпа Дж. (1997). Porphyromonas gingivalis протеиназы как факторы вирулентности в развитии пародонтита. J. Пародонтология. Res. 32 120–125. 10.1111 / j.1600-0765.1997.tb01392.x [PubMed] [CrossRef] [Google Scholar]
- Ван Стинберген Т. Дж., Делемар Ф. Г., Намавар Ф., Де Граафф Дж. (1987). Различия в вирулентности между видами Bacteroides gingivalis. Антони Ван Левенгук 53 233–244. 10.1007 / BF003 [PubMed] [CrossRef] [Google Scholar]
- Ватанабэ К., Ямаджи Ю., Умемото Т. (1992). Корреляция между клеточной адгезивной активностью и структурой поверхности у Porphyromonas gingivalis . Oral Microbiol. Иммунол. 7 357–363. 10.1111 / j.1399-302X.1992.tb00636.x [PubMed] [CrossRef] [Google Scholar]
- Wiebe C. B., Putnins E. E. (2000). Система классификации заболеваний пародонта Американской академии пародонтологии — обновление. J. Can. Вмятина. Доц. 66 594–597. [PubMed] [Google Scholar]
- Уильямс К. Э., Давенпорт Э. С., Стерн Дж. А., Сивапатхасундарам В., Ферн Дж. М., Кертис М. А. (2000). Механизмы риска у недоношенных новорожденных с низкой массой тела. Пародонтология 2000 г. 142–150. 10.1034 / j.1600-0757.2000.2230115.x [PubMed] [CrossRef] [Google Scholar]
- Уильямс Р. О., Фельдманн М., Майни Р. Н. (1992). Фактор противоопухолевого некроза облегчает заболевание суставов при артрите, индуцированном коллагеном у мышей. Proc. Natl. Акад. Sci. США 89 9784–9788. 10.1073 / pnas.89.20.9784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ян Дж., Ву Дж., Лю Ю., Хуанг Дж., Лу З., Се Л. и др. . (2014). Porphyromonas gingivalis Инфекция снижает уровень регуляторных Т-лимфоцитов у инфицированных пациентов с атеросклерозом. PLoS ONE 9: e86599 10.1371 / journal.pone.0086599 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Йемваттана И., Каомонгколгит Р. (2015).Альфа-мангостин подавляет экспрессию IL-6 и IL-8 в P. gingivalis LPS-стимулированных фибробластах десен человека. Стоматология 103 348–355. 10.1007 / s10266-014-0160-7 [PubMed] [CrossRef] [Google Scholar]
- Йошимура А., Хара Ю., Канеко Т., Като И. (1997). Секреция ИЛ-1 бета, ФНО-альфа, ИЛ-8 и ИЛ-1ra полиморфно-ядерными лейкоцитами человека в ответ на липополисахариды пародонтопатических бактерий. J. Periodontal Res. 32 279–286. 10.1111 / j.1600-0765.1997.tb00535.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Мураками Ю., Нисикава К., Хасегава Ю., Каваминами С. (2009). Компоненты поверхности Porphyromonas gingivalis . J. Periodontal Res. 44 год 1–12. 10.1111 / j.1600-0765.2008.01135.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Ватанабе К., Такасава Т., Каванами М., Като Х. (1989). Очистка и свойства 75-килодальтонного основного белка, иммунодоминантного поверхностного антигена, из орального анаэроба Bacteroides gingivalis. Заражение. Иммун. 57 год 3646–3652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зенобия К., Хаджишенгаллис Г. (2015). Porphyromonas gingivalis Факторы вирулентности, участвующие в разрушении лейкоцитов и микробном дисбактериозе. Вирулентность 6 236–243. 10.1080 / 21505594.2014.999567 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhang T., Hashizume T., Kurita-Ochiai T., Yamamoto M. (2009). Сублингвальная вакцинация белком внешней мембраны Porphyromonas gingivalis и лигандом Flt3 вызывает защитный иммунитет в полости рта. Biochem. Биофиз. Res. Commun. 390 937–941. 10.1016 / j.bbrc.2009.10.081 [PubMed] [CrossRef] [Google Scholar]
- Чжан В., Джу Дж., Ригни Т., Триббл Г. Д. (2011). Фимбрии Porphyromonas gingivalis важны для начальной инвазии остеобластов, но не для ингибирования их дифференцировки и минерализации. J. Periodontol. 82 909–916. 10.1902 / jop.2010.100501 [PubMed] [CrossRef] [Google Scholar]
Обзор пародонтопатогенных микроорганизмов ниже линии десен
Front Microbiol.2016; 7: 53.
Kah Yan How
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
Кеанг Пенг Сонг
2 Школа Science, Университет Монаш, кампус Sunway, Субанг-Джая, Малайзия
Кок Ган Чан
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
1 Отделение генетики и молекулярной биологии, Институт биологических наук, факультет естественных наук, Малайский университет, Куала-Лумпур, Малайзия
2 Школа естественных наук, Университет Монаш Кампус Санвей, Субанг Джая, Малайзия
Отредактировал: Laurel L .Ленц, Медицинский факультет Университета Колорадо, США
Рецензент: Пол Фиш, Медицинский центр Университета Фрайбурга, Германия; Чарльз С. Колдуэлл, Университет Цинциннати, США
Эта статья была отправлена в Microbial Immunology, раздел журнала Frontiers in Microbiology
Поступила 31 октября 2015 г .; Принято 12 января 2016 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) или лицензиара и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Заболевания пародонта представляют собой группу воспалительных инфекций полости рта, вызываемых патогенами полости рта, которые существуют в виде сложных биопленок на поверхности зуба и вызывают разрушение опорных тканей зуба.Тяжесть этого заболевания варьируется от легкого и обратимого воспаления десен (гингивита) до хронического разрушения соединительных тканей, образования пародонтального кармана и, в конечном итоге, приводит к потере зубов. В то время как поддесневой налет человека содержит более 500 видов бактерий, обширные исследования показали, что Porphyromonas gingivalis , грамотрицательная анаэробная бактерия, является основным этиологическим агентом, вызывающим хронический пародонтит. Эта бактерия с черным пигментом продуцирует множество факторов вирулентности, которые прямо или косвенно вызывают разрушение тканей пародонта, модулируя воспалительную реакцию хозяина.Здесь в этом обзоре представлен обзор P. gingivalis и того, как его факторы вирулентности влияют на патогенез с другим консорциумом микробиома в полости рта.
Ключевые слова: Porphyromonas gingivalis , оральный возбудитель, пародонтоз, гингивит, факторы вирулентности, воспалительная реакция
Введение
Заболевания пародонта — сложные, многофакторные, полимикробные инфекции, характеризующиеся разрушением поддерживающих зуб тканей.Заболевание начинается с острого воспаления десневой ткани и невылеченных инфекций, которые могут прогрессировать до образования карманов в зубах и, в конечном итоге, потери зубов. По данным Всемирной организации здравоохранения, заболевания пародонта поражают 10–15% взрослого населения во всем мире (Petersen and Ogawa, 2012).
Существенные данные, накопленные за эти годы, указывают на участие лишь небольшой части бактерий, обитающих в поддесневой нише, в возникновении и прогрессировании заболеваний пародонта.Существуют убедительные доказательства, указывающие на Porphyromonas gingivalis , грамотрицательные анаэробы, как на ключевой вид в развитии хронического пародонтита.
В последние десятилетия обширных исследований P. gingivalis были получены различные доказательства вклада этого анаэроба в прогрессирование периондонта. Эти данные важны для улучшения нашего понимания характеристик вирулентности и клеточного взаимодействия между P.gingivalis и хозяина, тем самым выясняя потенциальные терапевтические подходы к контролю прогрессирования заболеваний пародонта.
Флора ротовой полости и нормальный периодонт
Ротовая полость обладает рядом особенностей, которые делают ее особой средой обитания для целого зверинца микроорганизмов. Поверхности ротовой полости большую часть времени непрерывно омываются слюной в узком диапазоне температур (от 34 до 36 ° C) и pH, близком к нейтральному (Marcotte and Lavoie, 1998). Обнаружено, что в такой идеальной среде различные классы микрофлоры распределены в различных экологических нишах (Parahitiyawa et al., 2010).
В целом во рту обитает не менее шести миллиардов бактерий, которые представлены более чем 700 видами (Theilade, 1990; Aas et al., 2005), а также другими типами микроорганизмов, включая грибы, микоплазмы, простейшие и возможно, даже вирусы (Pennisi, 2005). Как правило, бактерии полости рта можно в широком смысле классифицировать как грамположительные и грамотрицательные бактерии, а также как анаэробные или факультативно анаэробные в соответствии с их потребностями в кислороде. Некоторые из наиболее часто выделяемых микроорганизмов в ротовой полости человека перечислены в таблице Таблица .
Таблица 1
Преобладающая микробиота полости рта человека.
| Группа микробов | Род / вид микробов |
|---|---|
| Грам-положительный | |
| Аэробный или факультативный | Стрептококк (S. gordonii, S. mitis, S. auralis, S. salivarius) |
| Стафилококк (S. aureus, S. epidermidis) | |
| Энтерококк (E.faaecalis) | |
| Lactobacillus (L. casei, L. fermentum) | |
| Коринебактерии (C. matruchotii) | |
| Actinomyces (A. naeslundii, A. israelli, A. viscosus) | |
| Арахния (A. propionica) | |
| Ротия (R. dentocariosa) | |
| Облигатные анаэробы | Bacillus (B.cereus) |
| Propionibacterium (P. acnes) | |
| Пептострептококк (P. micros, P. anaerobius) | |
| Грамотрицательные | |
| Аэробный или факультативный | Campylobacter (C. rectus, C. concisus, C. gracilis) |
| Actinobacillus (A. actinomycetemcomitans) | |
| Облигатные анаэробы | Fusobacterium (F.nucleatum) |
| Porphyromonas (P. gingivalis) | |
| Prevotella (P. melaninogenica, P. oralis, P. intermedia) |
микробиота, ротовая полость, тем не менее, характеризуется стабильным сообществом, известным как сообщество климакса. Следовательно, если возникает дисбаланс в микробиоте, постоянно проживающей в ротовой полости, появляются такие заболевания полости рта, как кариес и заболевания пародонта, что приводит к размножению потенциально патогенных микроорганизмов.Несколько исследований показали, что изменение видов микробов в десневой борозде с грамположительных, факультативных, ферментативных микроорганизмов на преимущественно грамотрицательные, анаэробные, хемоорганотрофные и протеолитические организмы в значительной степени связано с разрушением тканей пародонта (Eloe-Fadrosh and Раско, 2013).
Заболевания пародонта
Заболевания пародонта обычно относятся к воспалительному патологическому состоянию десны и поддерживающих структур пародонта, включая десну, альвеолярную кость, периодонтальную связку и цемент.Они обычно встречаются в большинстве человеческих популяций и приводят к значительной заболеваемости с отслаиванием зубов в тяжелом состоянии. В Соединенных Штатах последние эпидемиологические данные показывают, что заболевание периондонта поражает половину населения в возрасте старше 30 лет и является основной причиной потери зубов среди взрослых (Bostanci and Belibasakis, 2012). Согласно системе классификации заболеваний пародонта, предложенной Американской академией пародонтологии (AAP), заболевания пародонта обычно делятся на две основные категории: заболевания десен и пародонтит, в зависимости от того, произошло ли разрушение прикрепления пародонта (Wiebe and Putnins, 2000). ).
Заболевание десен определяется как воспаление тканей десны, вызванное скоплением зубного налета, и клинически характеризуется покраснением, отеком и кровотечением тканей. Поскольку периодонтальная связка и альвеолярная кость не вовлечены в это событие, прикрепление зубов не затрагивается (Williams et al., 1992). Гингивит может сохраняться неопределенно долго в течение длительного периода и не перерастет в пародонтит, если нет нарушений местных условий или общей восприимчивости хозяина (Offenbacher, 1996).
С другой стороны, пародонтит относится к необратимому воспалению тканей пародонта, вызванному бляшками, которое приводит к разрушению периодонтальной связки и альвеолярной кости и миграции эпителиальной связки. Впоследствии это вызывает образование пародонтального кармана, что является основным клиническим признаком пародонтита (Williams et al., 1992). Этот карман является идеальной поверхностью для бактериальной колонизации и образования поддесневого налета.
Различные исследования показали, что пародонтит чаще встречается у пациентов с системными заболеваниями, такими как сахарный диабет, СПИД, лейкемия и синдром Дауна (Komatsu, 2014; Mehta, 2015).Все больше данных свидетельствует о том, что пародонтит может повышать риск нескольких потенциально смертельных состояний, включая сердечно-сосудистые заболевания (например, сердечный приступ, ишемическую болезнь сердца и инсульт) и диабет (Saremi et al., 2005; Friedewald et al., 2009) . Согласно отчету AAP в 1996 году, было обнаружено, что люди с некоторыми формами заболеваний десен почти в два раза чаще страдают ишемической болезнью сердца по сравнению с людьми со здоровыми деснами.
В течение многих лет проводились многочисленные исследования, показывающие возможную связь между заболеваниями пародонта и сердечно-сосудистыми заболеваниями.Недавние исследования, такие как исследование Nakano et al. (2006) попытались показать прямые механизмы, связывающие заболевания пародонта с сердечно-сосудистыми заболеваниями. Для объяснения этой ассоциации был предложен ряд механизмов, включая общий фактор, который предрасполагает некоторых людей к гипервоспалительной реакции при сердечно-сосудистых заболеваниях (Beck et al., 1996). Считается, что оральные патогены могут попадать в кровоток, а воспаление, вызванное заболеваниями пародонта, увеличивает образование зубного налета, что впоследствии способствует расширению артерий (Bartold and Narayanan, 2006). На рисунке показана упрощенная диаграмма потенциальных ролей, которые воспаление пародонта может играть в патогенезе сердечно-сосудистых заболеваний.
Упрощенное изображение, показывающее связь хронического воспаления пародонта и патогенеза сердечно-сосудистых заболеваний. По материалам Bartold and Narayanan (2006).
Streptococcus mutans , основной патогенный агент кариеса зубов, обнаруживался с необычно высокой частотой как в тканях сердечного клапана, так и в образцах атероматозных бляшек, чем любые другие виды (Nakano et al., 2006). Фактически, вместе с P. gingivalis ранее было обнаружено, что S. mutans ускоряет образование атерогенных бляшек на мышиной модели и вызывает агрегацию тромбоцитов, что предположительно приводит к образованию тромба (Herzberg and Meyer, 1996; Kuramitsu et al., 2001 ). Последнее исследование Oliveira et al. (2015) показали, что S. mutans, Prevotella intermedia, P. gingivalis и Treponema denticola часто обнаруживались в образцах сердечного клапана с использованием метода полимеразной цепной реакции (ПЦР), что подтверждает предыдущие выводы.Высокая частота обнаружения S. mutans в образцах зубного налета может свидетельствовать о том, что S. mutans , обнаруженные в образцах клапана, произошли из полости рта. Однако есть опасения по поводу возможности обнаружения ДНК мертвых бактерий из-за высокой чувствительности ПЦР в реальном времени.
С другой стороны, Американская кардиологическая ассоциация отметила, что ни пародонтоз не вызывает атеросклеротическое заболевание сосудов, ни лечение пародонта не предотвращает атеросклеротическое сосудистое заболевание (Lockhart et al., 2012). Это было подтверждено отчетом Hayashi et al. (2015), в которых отсутствует сильная корреляция между состоянием пародонта и параметрами статуса артериосклероза у пациентов с ишемической болезнью сердца. Однако это исследование также имеет некоторые ограничения, например, пациенты без ишемической болезни сердца были исключены, а образцы биомаркеров не были собраны из разных областей полости рта, чтобы отразить местные воспалительные состояния.
Сообщалось, что заболевания пародонта и сердечно-сосудистые заболевания имеют общие факторы риска, такие как курение, сахарный диабет, старение и ожирение (Genco and Borgnakke, 2013).Системные воспалительные маркеры также были обнаружены при обоих заболеваниях. Следовательно, доказательство корреляции между этими двумя заболеваниями остается сложной задачей. Другие общие факторы, включая образ жизни и личную гигиену, также сыграли важную роль в обоих заболеваниях. Из-за большого количества противоречивой литературы существует необходимость в дополнительных долгосрочных исследованиях, чтобы установить сильную причинную связь между заболеваниями пародонта и сердца.
Помимо сердечно-сосудистых заболеваний, исследования in vitro, и модели на животных предполагают, что P.gingivalis может нарушать иммунную толерантность у восприимчивых людей и усугублять ревматоидный артрит за счет ферментативной модификации белков хозяина (Maresz et al., 2013). Кроме того, было обнаружено, что пародонтоз является фактором риска для недоношенных детей с низкой массой тела при рождении (Ali and Abidin, 2012). Медиаторы воспаления, возникающие при пародонтозе, играют решающую роль в инициировании родов, и существуют вероятные механизмы, которые могут связать эти два состояния (Williams et al., 2000). Основываясь на эпидемиологических и микробиологических иммунологических исследованиях, постулируемые механизмы включают транслокацию патогенов пародонта в фетоплацентарную единицу и действие пародонтального резервуара факторов вирулентности в качестве медиаторов воспаления. Однако взаимосвязь между неблагоприятными исходами беременности и ответом материнских антител на P. gingivalis требует дальнейшего изучения (Madianos et al., 2013).
Бактериальная этиология заболеваний пародонта
За эти несколько десятилетий были достигнуты большие успехи в понимании патогенеза и естественного течения заболеваний пародонта.Тем не менее, исследования, проведенные в 1930-1970-х годах, не смогли идентифицировать конкретные бактерии как этиологические агенты заболеваний пародонта. Таким образом, была предложена «неспецифическая теория», которая выдвигает гипотезу о том, что заболевание пародонта вызвано консорциумом микроорганизмов, а не важностью каких-либо видов бактерий как единственных возбудителей (Theilade, 1986). Однако в конце 1970-х и позже были выделены более специфические микроорганизмы в качестве этиологических агентов пародонтита (Tanner et al., 1979; Слотс и др., 1986; Мур и Мур, 1994).
В настоящее время широко признано, что мириады бактерий, а не ни один микроорганизм, вовлечены в заболевания пародонта. Фактически, воспаление тканей пародонта вызвано колонизацией поддесневой области бактериями пародонта. Например, на поверхности зубов ранними или первичными колонизаторами являются в основном стрептококки и актиномицеты. Со временем пропорции этих грамположительных факультативно анаэробных бактерий уменьшаются, и в конечном итоге грамотрицательные анаэробы становятся более устойчивыми, особенно на границе раздела зубов и десен (Jenkinson and Lamont, 2006).
Тем не менее, сложные взаимодействия между бактериальной флорой и защитными механизмами хозяина существенно влияют на баланс между бактериальной агрессией и защитой хозяина и, таким образом, определяют, происходит ли разрушение пародонта (Hajishengallis et al., 2012). В свете этих критериев ряд экспериментальных данных продемонстрировал, что первичными этиологическими агентами заболеваний пародонта обычно являются грамотрицательные палочки, которые включают Actinobacillus actinomycetemcomitans, Tannerella forsythia (ранее обозначенные как Bacteroides forsythus ), Prevotella, Fusobacterium , и P.gingivalis. Ни один из этих видов микробов не способен вызывать деструктивные события, связанные с прогрессированием заболеваний пародонта, но этиология требует согласованного взаимодействия этих членов для создания своих ниш в полости рта (Marcotte and Lavoie, 1998; Maiden et al., 2003; Paster et al., 2006).
Porphyromonas Gingivalis и его распространенностьСреди основных патогенов пародонта P. gingivalis , по-видимому, является одним из основных этиологических агентов в патогенезе и прогрессировании воспалительных явлений пародонтоза (Hajishengallis et al., 2012). Эта пародонтопатическая бактерия была обнаружена в 85,75% образцов поддесневого налета от пациентов с хроническим пародонтитом (Datta et al., 2008). Эта неподвижная асахаролитическая грамотрицательная бактерия представляет собой облигатно анаэробную палочку, которая образует колонии с черным пигментом на чашках с кровяным агаром (, фиг. ). В процессе роста ему абсолютно необходимо железо. Ранее он назывался Bacteroides gingivalis до его реклассификации в новый род Porphyromonas (Nisengard and Newman, 1994).Название Porphyromonas происходит от греческого прилагательного porphyreos , означающего пурпурный, и греческого существительного monas , означающего единицу. Следовательно, слово Porphyromonas означает порфириновые клетки, поскольку колонии на пластинах с кровяным агаром становятся черными через 6–10 дней из-за накопления гема (Shah and Collins, 1988).
Черные пигментированные колонии пародонтопатогена P. gingivalis на агаре с лошадиной кровью. Считается, что пигмент связан с накоплением гемина (окисленной формы гема) на поверхности клеток при выращивании на кровяном агаре.
Основным местом обитания P. gingivalis является поддесневая борозда ротовой полости человека. Он основан на ферментации аминокислот для производства энергии, свойства, необходимого для его выживания в глубоком периодонтальном кармане, где доступность сахара низкая (Bostanci and Belibasakis, 2012). Являясь облигатным анаэробом, P. gingivalis служит вторичным колонизатором зубного налета, часто прилипая к первичным колонизаторам, таким как Streptococcus gordonii и P.промежуточный. Исследование Bodet et al. (2006) продемонстрировали, что эта асахаролитическая бактерия связана с T. denticola и T. forsythia с образованием комплекса красных бактерий, который широко распознается при поздних поражениях пародонта. Дополнительные доказательства присутствия P. gingivalis также получены из иммунологических исследований (Moore et al., 1991; Schmidt et al., 2014). Практически все исследователи согласны с тем, что уровни сывороточных антител к P. gingivalis выше у пациентов с диагнозом пародонтит у взрослых (Mahanonda et al., 1991; Casarin et al., 2010).
В последние несколько десятилетий штамм P. gingivalis были классифицированы на инвазивные и неинвазивные штаммы на основе их способности образовывать абсцессы на модели мышей. Было продемонстрировано, что инвазивный штамм P. gingivalis обладает большей патогенной активностью, чем неинвазивный штамм как in vitro , так и in vivo (Dorn et al., 2000; Baek et al., 2015).
Наличие п.gingivalis , действующий либо отдельно, либо как смешанная инфекция с другими оральными патогенами, и, возможно, дефицит определенных иммунологических факторов у хозяина, по-видимому, имеет важное значение для этиологии прогрессирующего пародонтита (Haffajee and Socransky, 1994). Было показано, что количество P. gingivalis значительно увеличивается в участках с пародонтитом и ниже или не обнаруживается на участках с поддесневым здоровьем или гингивитом, связанным с бляшками (Schmidt et al., 2014). Обычно он в большей степени находится в глубоких, чем в неглубоких пародонтальных карманах (Ali et al., 1996). Около 40–100% взрослых пациентов с пародонтитом инфицированы этими условно-патогенными бактериями.
При высокой частоте встречаемости P. gingivalis в очагах пародонтита у взрослых имеется сильная гипотеза, что P. gingivalis взаимодействуют с другими членами микробиоты хозяина, синтезируя различные патогенные факторы, что приводит к прогрессированию заболевания. Однако то, как P. gingivalis взаимодействует с селективными клетками-хозяевами для производства деструктивных биологических молекул и запускает преобразование здоровой ткани ротовой полости в болезненное состояние, еще неизвестно (Holt et al., 1999).
Факторы вирулентности
P. gingivalisИндукция и прогрессирование деструкции тканей пародонта представляют собой сложные процессы, включающие накопление бляшек, высвобождение бактериальных веществ и воспалительную реакцию хозяина. P. gingivalis , как известно, продуцирует набор факторов вирулентности, которые могут проникать в десны и вызывать разрушение тканей прямо или косвенно, вызывая воспаление (Hajishengallis et al., 2012). Факторы вирулентности можно определить как компоненты или метаболиты организма, которые необходимы на различных стадиях жизненного цикла и вызывают повреждение хозяина.Способность организма колонизировать и уклоняться от антибактериальных защитных механизмов хозяина, а также способность производить вещества, которые могут инициировать разрушение тканей, являются неотъемлемыми характеристиками успешного патогена. Некоторые факторы вирулентности приведены в Таблице .
Таблица 2
Факторы вирулентности и эффекторы хозяина, продуцируемые P. gingivalis.
| Факторы вирулентности | Влияние на уклонение от хозяина |
|---|---|
| Ферменты (гиалуронидаза, хондроитинсульфатаза), капсула | Снижение фагоцитоза для инвазии, ингибиторы хемотаксиса B |
| Фимбрии, экзополисахарид, белки внешней мембраны | Адгезия или прикрепление к внешней мембране хозяина |
| Коллагеназа, трипсиноподобная протеаза, желатиназа | Деградация ингибиторов протеаз плазмы, разрушение ткани пародонта |
| Аминопептидаза | Деградация белка транспорта железа |
Чтобы выжить и размножаться в организме хозяина, вторгающемуся патогену необходимо преодолеть внешние защитные барьеры хозяина, прежде чем он сможет найти подходящую экологическую нишу для колонизации.Колонизация тканей хозяина могла происходить только в присутствии факторов вирулентности, таких как фимбрии, капсулы, липополисахарид (ЛПС), липотейхоевые кислоты, гемагглютинины, гингипаины, белки внешней мембраны и везикулы внешней мембраны (Holt et al., 1999; Hajishengallis and Ламонт, 2014). Выражение факторов вирулентности часто регулируется в ответ на изменения во внешней среде пародонтопатогена. Если эти факторы вирулентности активны в восприимчивом хозяине, они могут привести к быстрому и значительному разрушению тканей пародонта, резорбции костей, индукции ответов хозяина за счет продукции цитокинов, а также к ингибированию защитных механизмов хозяина.Однако экспрессия этих детерминант вирулентности и их механизм на различных стадиях заболевания пародонта широко не исследовались. Для полного понимания конкретной функции каждого фактора и его механизма в патогенезе требуется инактивация факторов в сочетании с биохимической оценкой и тестированием на вирулентность in vivo и .
Капсулы
Чтобы прижиться в полости рта, микроорганизмы должны сначала прикрепиться к зубам или поверхностям слизистой оболочки (Yoshimura et al., 2009). Соблюдение режима лечения необходимо для обеспечения сопротивления потоку слюны. Приверженность обычно опосредуется адгезинами на поверхности бактерий и рецепторами на поверхности полости рта. Микробные адгезины обнаруживаются как компоненты клеточной стенки или связаны с клеточными структурами, такими как капсулы или фимбрии (Marcotte and Lavoie, 1998). Химический состав капсулы у разных штаммов различается, главным образом, по составу сахара. Например, P. gingivalis ATCC 53977 не содержит галактозу, но богат аминосахарами. P. gingivalis обнаруживает, по крайней мере, шесть серотипов капсульных антигенов, которые включают K1 – K6 (Laine et al., 1997).
В одном из самых ранних исследований сообщалось, что высокоинкапсулированные штаммы P. gingivalis демонстрируют пониженную аутоагглютинацию, меньшую плотность и более гидрофильны, чем неинкапсулированные штаммы (Van Steenbergen et al., 1987). Согласно Singh et al. (2011), повышенная инкапсуляция также коррелирует с повышенной устойчивостью к фагоцитозу, сывороточной резистентностью и пониженной индукцией хемилюминесценции полиморфно-ядерных лейкоцитов.Кроме того, обнаружено, что капсула участвует в возмущении эпителиальных клеток десны. Исследования Dierickx et al. (2003) выявили, что наличие и тип капсулы оказали значительное влияние на начальную адгезию P. gingivalis к эпителиальным клеткам пародонтального кармана человека. Однако следует отметить, что капсула может взаимодействовать с поверхностным белком, облегчая прикрепление к клеткам-хозяевам. С другой стороны, уровень и механизм коагрегации между P.gingivalis и другой периодопатоген Fusobacterium nucleatum , как было показано, также зависят от капсулы (Rosen and Sela, 2006). Другое исследование Katz et al. (1996) выявили, что вирулентные штаммы P. gingivalis W83 и W50 с более толстыми капсулами вызывают снижение продукции лейкоцитов, чем менее вирулентные штаммы, такие как штамм 376. Это ясно указывает на то, что наблюдаемое различие в штаммах вирулентности является вероятно, из-за разницы в капсульной структуре и адгезионной способности.
Исследования с использованием моделей инфицирования мышей показали, что за счет защиты компонентов микробной поверхности инкапсулированные штаммы P. gingivalis более вирулентны, чем неинкапсулированные штаммы. Неинкапсулированные штаммы обычно вызывают неинвазивные локализованные абсцессы, тогда как инкапсулированные штаммы вызывают инвазивные распространяющиеся флегмонозные инфекции после подкожной инокуляции экспериментальным животным. Неинкапсулированные штаммы также подвергаются усиленному фагоцитозу или быстро убиваются макрофагами и дентритными клетками (Laine et al., 1997). Напротив, с точки зрения эффективности инвазии, капсула P. gingivalis делает ее менее эффективной при проникновении в фибробласты десны по сравнению с некапсулярными штаммами (Irshad et al., 2012). Недавние открытия Brunner et al. (2010) продемонстрировали, что инкапсулированный P. gingivalis способен модулировать ответ хозяина на бактерии за счет снижения синтеза цитокинов интерлейкина-1 (IL-1), IL-6 и IL-8 фибробластами. Помимо своих иммуномодулирующих свойств, на модели абсцесса на мышах было показано, что капсула способствует вирулентности за счет уменьшения фагоцитоза и, таким образом, увеличения выживаемости бактерий в клетках-хозяевах и, в конечном итоге, долгосрочного воспалительного ответа (Singh et al., 2011). Однако влияние окислительного стресса на экспрессию капсулы не принималось во внимание, поскольку эксперименты проводились в анаэробных условиях. Необходимы дальнейшие проверки, чтобы показать более точный вклад капсулы в патогенность. Помимо выживаемости бактерий, капсула также может способствовать увеличению выживаемости за счет снижения бактерицидного эффекта небольшого антимикробного пептида, известного как дефенсины (Igboin et al., 2011). В этом исследовании использовалась модель киллинга Drosophila melanogaster для характеристики реакции хозяина на P.gingivalis инфекция. Следовательно, результаты могут быть не очень значимыми, поскольку Drosophila не является естественным хозяином для P. gingivalis , и взаимодействия хозяин-патоген не могут быть изучены с использованием этого организма.
В последнее десятилетие регуляторные механизмы синтеза капсульной поверхности были объектом пристального внимания. Считается, что механизмы довольно сложны и включают посттранскрипционную регуляцию и экспрессию биосинтетического аппарата из множества локусов.На сегодняшний день у P. gingivalis идентифицировано только два различных регуляторных механизма. One представляет собой тирозинфосфатазу (Ltp1), кодируемую PG1641, которая контролирует экспрессию ряда генов, кодирующих белки, участвующие в синтезе поверхностных полисахаридов. В мутанте с делецией ltp1 экспрессия капсулы К-антигена подавлялась (Maeda et al., 2008). Вторым регуляторным механизмом, который был идентифицирован, является β-субъединица HU белка DNABII (PG0121), которая аналогичным образом вызвала снижение экспрессии локуса синтеза K-антигена у мутанта PG0121 (Priyadarshini et al., 2013; Tjokro et al., 2014). Последнее исследование Bainbridge et al. (2015) продемонстрировали, что молекула антисмысловой РНК, которая кодируется внутри инвертированного повторяющегося элемента из 77 п.н. около 5′-конца генов синтеза капсулы K-антигена, влияет на экспрессию капсульной поверхности вирулентного штамма W83 P. gingivalis . Удаление этого элемента снижает синтез капсулы и изменяет структуру LPS (Bainbridge et al., 2015). Эти основные результаты важны для выяснения регуляторной роли вторичной структуры РНК в модулировании синтеза капсулы К-антигена.Однако неизвестно, является ли антисмысловая РНК подлинной РНК или кодирует сигнальный пептид. Кроме того, неизвестно, могут ли другие регуляторные гены играть роль во взаимодействии с другими белками или ферментами при производстве капсул.
Фимбрии
Фимбрии — это тонкие белковые придатки на поверхности, которые выступают из внешней мембраны бактериальной клетки. Эти структуры длиной 3–25 мкм являются укрытием для большинства штаммов P. gingivalis . Исследование P.gingivalis fimbriae имеет долгую историю, восходящую к 1980-м годам (Handley and Tipler, 1986). Исследования показали, что P. gingivalis экспрессирует две различные фимбрии на своей клеточной поверхности: одна состоит из субъединичного белка (названного FimA или фимбриллин), кодируемого геном fimA (названного длинными или основными фимбриями), а другая субъединица Mfa белок кодируется геном mfa1 (называемым короткими, минорными или фимбриями Mfa1). Несмотря на то, что две фимбрии антигенно различаются и различаются по своему аминокислотному составу, считается, что они способствуют прогрессированию воспалительных реакций пародонта (Amano et al., 2010). Интересно, что основная фимбрия-подобная структура была обнаружена у штамма P. gingivalis , в котором не были обнаружены ни FimA, ни Mfa1 фимбрии. Эти новые фимбрии 53 кДа являются еще одним основным белком внешней мембраны P. gingivalis (Nagano et al., 2015).
В зависимости от штамма белок FimA имеет размер от 40,5 до 49 кДа. Основываясь на аминоконце и последовательностях ДНК, он подразделяется на шесть типов: типы I – V и Ib (Fujiwara et al., 1993; Hajishengallis et al., 2008). Штаммы с типом IV FimA, такие как штаммы W50 и W83, плохо фимбрируются. Штаммы 381, ATCC 33277 и HG565, напротив, представляют собой штаммы типа I с обильно фимбриированными клетками, которые обладают значительной адгезией к тканям хозяина. Сообщалось, что у большинства пародонтальных пациентов были штаммы FimA типа II, за которыми следовали штаммы типа IV (Amano et al., 2004).
Исследования малых фимбрий массой 67 кДа очень ограничены. Клональное разнообразие минорных фимбрий среди штаммов P. gingivalis изучено недостаточно.Подобно белку FimA, отдельные минорные молекулы фимбрий, FimCDE, обнаруживаются в разных штаммах. Исследование Amano et al. (2004) продемонстрировали, что минорные фимбрии стимулировали выработку макрофагами интерлейкина-1α (IL-1α), IL-1β, IL-6 и фактора некроза опухоли-α (TNF-α). Постулируется, что малая фимбрия является причинным фактором резорбции альвеолярной кости в моделях на животных. Это исследование, однако, требует дальнейшей проверки, поскольку клональное разнообразие малых фимбрий неясно, но, вероятно, способствует прогрессированию пародонтита у человека.
Ранние исследования в 1990-х на штаммах P. gingivalis с дефицитом фимбрий выявили важную роль фимбрий в связывании, а также во вторжении в клетки-хозяева (Lee et al., 1992; Sharma et al., 1993). Он также обеспечивает прилипание к широкому спектру субстратов и молекул ротовой полости, включая белки внеклеточного матрикса, эпителиальные и комменсальные бактерии полости рта, такие как стрептококки и Actinomyces viscosus (Amano, 2007). Амано (2010) сообщил, что фимбрии типа II способны прикрепляться к клеточному α 5 β 1 -интегрину, что позволяет бактериям легко поглощаться фагоцитами хозяина и дендритными клетками и вызывает перестройку актинового цитоскелета для облегчения интернализации.Впоследствии это позволяет внутриклеточным бактериям нарушать клеточную функцию хозяина за счет факторов вирулентности (Zenobia and Hajishengallis, 2015; , рисунок ). Сообщалось, что основные фимбрии участвуют в начальной инвазии остеобластов с помощью P. gingivalis , но не являются существенными для последующего ингибирования дифференцировки и минерализации остеобластов (Zhang et al., 2011).
P. gingivalis Манипуляции с входом в дендритные клетки с использованием минорных фимбрий Mfa1 и дополнительных белков. Адгезивные свойства фимбрий позволяют P. gingivalis избегать клеток-хозяев и избегать иммунного надзора. По материалам Зенобии и Хаджишенгаллиса (2015).
Во многих сообщениях утверждается, что остатки FimA в фимбриях связываются с молекулами-мишенями, но сообщается, что минорные компоненты FimCDE критически функционируют как адгезин (Yoshimura et al., 2009). Белок FimA не был существенным для инвазивных способностей везикул внешней мембраны P. gingivalis .Тем не менее, большее количество белковых компонентов, связанных с везикулами, происходящими из фимбриированного штамма, интернализуется в фибробласты десен человека по сравнению с фимбриированным штаммом (Mantri et al., 2015). Кроме того, фимбрия P. gingivalis действуют как важный фактор вирулентности в прогрессировании атеросклероза. Сообщалось, что инфекция P. gingivalis снижает уровень регуляторных Т-клеток (Tregs) у пациентов с атеросклерозом. Во время этого процесса Treg могут играть решающую роль в аутоиммунном ответе.Однако остается неизвестным, связана ли инфекция P. gingivalis с нарушением регуляции Treg во время атеросклероза, и распространенность различных генотипов P. gingivalis FimA во время этого процесса остается неясной (Yang et al., 2014).
Между тем, существуют различные соединения растительного происхождения, используемые для подавления активности P. gingivalis . Два из этих исследований были выполнены Murakami et al. (2015) о противовоспалительной активности кверцетина, ресвератрола и родственных ему соединений, катехина, эпикатехина, орцинола и 4-аллилфенола.Было продемонстрировано, что природные соединения проявляют ингибирующее действие на активность фимбрий P. gingivalis . Однако следует отметить, что необходимы дополнительные исследования различных штаммов P. gingivalis для поддержки вышеупомянутых гипотез, поскольку изменчивость штаммов может иметь различную патогенность.
Липополисахарид (ЛПС)
Липополисахарид (ЛПС) представляет собой относительно большую молекулу размером не менее 10 кДа. Он составляет важный компонент внешней мембраны бактерий (Hamada et al., 1994). В общем, бактериальный LPS состоит из дистального полисахарида (или O-антигена), неповторяющегося «основного» олигосахарида и гидрофобного домена, известного как липид A (или эндотоксин) (Ogawa and Yagi, 2010; , рисунок ). Липид A, самый внутренний компонент, представляет собой биологически активную область LPS, которая может вызывать нарушение регуляции врожденной иммунной системы млекопитающих путем взаимодействия с обоими toll-подобными рецепторами 2 и 4 (Darveau et al., 2004). Он имеет гетерогенные паттерны ацилирования, которые изменяются в зависимости от условий микроокружения и влияют на передачу сигналов иммунной системы хозяина, тем самым способствуя выживанию бактерий в организме хозяина (Al-Qutub et al., 2006).
Схематическая структура липополисахарида (ЛПС) внешней мембраны P. gingivalis . По материалам Ogawa and Yagi (2010).
У грамотрицательных бактерий ЛПС играет важную роль в поддержании клеточной и структурной целостности, а также в контроле проникновения гидрофобных молекул и токсичных химикатов. Фактически, сворачивание и вставка белка внешней мембраны не может происходить в отсутствие LPS (Silhavy et al., 2010).На основании своей биологической активности установлено, что ЛПС является важным патогенным фактором среди многих пародонтопатических бактерий. Ряд исследований сообщил о способности этого компонента внешней мембраны активировать воспалительные реакции хозяина и нарушать процесс ремоделирования костей (Herath et al., 2011; Kato et al., 2014). В клинически здоровом пародонте нормальная воспалительная реакция является фундаментальным компонентом системы защиты хозяина с выработкой IL-1. Считается, что IL-1 играет роль в патогенезе заболеваний пародонта через воспалительные реакции через активацию толл-подобного рецептора 4 (Bartold and Narayanan, 2006; Jain and Darveau, 2010).
Одна из возможных ролей LPS в P. gingivalis заключается в нарушении надзора за врожденным хозяином путем вмешательства в распределение лейкоцитов в непосредственной близости от бактериальной колонизации. Фактически, ЛПС P. gingivalis плохо распознается врожденной системой защиты хозяина по сравнению с ЛПС других грамотрицательных видов (например, Escherichia coli ) (Liu et al., 2008). Помимо этого, была парализована способность эпителиальных клеток десен секретировать хемокин интерлейкин 8 (IL-8), что нарушает активацию нейтрофилов, эозинофилов и базофилов (Yoshimura et al., 1997; Darveau et al., 1998). Это явление, известное как хемокиновый паралич, приводит к устойчивости к окислительному взрыву полиморфноядерными нейтрофилами. В отсутствие эффективной врожденной иммунной защиты хозяина количество пародонтальных бактерий может значительно увеличиться. Рост бактериальной популяции в области десен в сочетании с неспособностью системы защиты хозяина удалить их, согласуется с наблюдаемой этиологией пародонтоза. Помимо индукции синтеза провоспалительных цитокинов, P.gingivalis LPS ингибирует дифференцировку и минерализацию остеобластов в стволовых клетках периодонтальной связки, которые участвуют в регенерации тканей пародонта (Kato et al., 2014).
Кроме того, недавнее исследование на мышах продемонстрировало, что P. gingivalis LPS системно циркулирует более чем у 50% пародонтальных пациентов и, как было установлено, имеет более высокий уровень матриксной металлопротеиназы. Низкий системный LPS запускает воспалительную реакцию в левом желудочке через металлопротеиназу, тем самым вызывая сердечную дисфункцию (DeLeon-Pennell et al., 2013). Кроме того, ЛПС также стимулирует выработку тромбоспондина-1, многофункционального белка внеклеточного матрикса, секретируемого моноцитарными клетками человека. Тромбоспондин-1 стимулирует миграцию макрофагов и модулирует воспалительный ответ хозяина (Gokyu et al., 2014). Воспалительные реакции опосредуются множеством генов. Одним из них является мРНК-связывающий белок ингибитора активатора плазминогена типа I (PAI-1), который, как сообщалось, активируется в воспалительной десне при индуцировании P.gingivalis LPS (Na et al., 2014). Несмотря на то, что PAI-1 играет решающую роль в миграции клеток, необходимы дальнейшие исследования, чтобы понять функцию системы активатора плазминогена в сигнальном пути клетки.
Растущее количество свидетельств показывает, что некоторые природные соединения проявляют ингибирующее действие на ЛПС. Сообщалось, что альфа-мангостин вызывает снижение экспрессии IL-6 и IL-8 в фибробластах десен человека (Yiemwattana and Kaomongkolgit, 2015). Более недавнее открытие Ci et al.(2015) продемонстрировали ингибирующее действие экстрактов проантоцианидина виноградных косточек на ЛПС P. gingivalis , в то время как Derradjia et al. (2015) сообщили о роли альфа-токоферола в противодействии повреждающему эффекту ЛПС за счет снижения воспалительных цитокинов, увеличения бета-дефенсинов, антимикробного пептида и стимулирования роста и миграции фибробластов десны. С другой стороны, торментиновая кислота ингибирует LPS-индуцированный воспалительный ответ в фибробластах десен человека (Jian et al., 2015). Поскольку обнаружено, что мучная кислота обладает противовоспалительным действием, ингибируя выработку IL-6 и IL-8, она может быть возможным терапевтическим агентом при заболеваниях пародонта.
В недавнем исследовании Díaz et al. (2015) было обнаружено, что различия в профиле ЛПС клинических изолятов P. gingivalis влияют на морфологию колоний и устойчивость к полимиксину B. В отличие от здоровых субъектов, изоляты от субъектов пародонта обладали устойчивостью к полимиксину B и демонстрировали низкую способность к агрегации.Эта устойчивость сильно коррелирует с вариациями в профилях ЛПС, так как ЛПС здоровых субъектов не имеет высокомолекулярных антигенных составляющих O и анионного полисахарида (Díaz et al., 2015), тогда как изоляты P. gingivalis от пародонта продуцируют модифицированные липиды. Молекулы. Однако роль других компонентов ЛПС плохо изучена, и участие других факторов вирулентности в реакции на противомикробные соединения не принималось во внимание.
Еще один важный момент, на который стоит обратить внимание, — это экспрессия LPS в различных P.gingivalis , и их роль на различных стадиях инфекции до сих пор остается спорной. Одной из основных причин предположительно могло быть использование различных штаммов P. gingivalis , которые неизбежно плейотропны по отношению к другим патогенным свойствам. Следовательно, основа вариабельности ЛПС у разных штаммов еще не установлена.
Протеазы
Способность большинства штаммов P. gingivalis секретировать многочисленные гидролитические, протеолитические и липолитические ферменты вместе с токсичными метаболитами является одной из характеристик вирулентности, которая позволяет этим бактериям процветать в полости рта.Эти ферменты обычно находятся в непосредственной близости с клетками-хозяевами. В то время как некоторые ферменты находятся в периплазматическом пространстве, другие переносятся из внешней мембраны в пузырьки внешней мембраны во время роста. Один из типов ферментов, протеазы, по-видимому, сильно влияет на прогрессирование заболеваний пародонта. Среди этих протеаз — трипсин-, тиол-, казеинолитические протеиназы и пептидазы (Travis et al., 1997; Curtis et al., 2001).
Обычно существует два различных семейства протеаз, продуцируемых P.gingivalis . Одно из них — это семейство цистеиновых протеиназ, также известное как «трипсиноподобный» фермент, а другое — сериновая протеиназа (Bostanci and Belibasakis, 2012). «Трипсиноподобные» ферменты расщепляют полипептиды на С-конце после остатка аргинина или лизина. Эти протеиназы, обычно известные как гингипаины, а именно гингипаин R и K, расщепляются после аргинина и лизина соответственно. В совокупности они обеспечивают 85% внеклеточной протеолитической активности P. gingivalis в очаге инфекции (de Diego et al., 2014). Существует два типа гингипаина R, а именно RgpA и RgpB, и один тип гингипаина K, Kgp. Гингипаин R разрушает компоненты внеклеточного матрикса, включая интегрин-фибронектин-связывающий, цитокин, иммуноглобулин и факторы комплемента (Curtis et al., 2001). Это также жизненно важно для обработки и созревания основных фимбрий (FimA) (Kristoffersen et al., 2015). И гингипаин R, и K были выделены из многих штаммов P. gingivalis , выращенных в различных условиях.
Имеются убедительные доказательства того, что протеазы P. gingivalis непосредственно участвуют в колонизации пародонтального кармана, что приводит к разрушению поддерживающей ткани пародонта (Andrian et al., 2004; Dubin et al., 2013). Кроме того, протеазы также придают микроорганизмам высокую устойчивость к защитным механизмам хозяина. Обширные исследования за последнее десятилетие показали, что протеазы P. gingivalis участвуют в деградации белков внеклеточного матрикса, таких как коллаген, активации металлопротеиназ матрикса хозяина, инактивации ингибиторов протеиназ плазмы, расщеплении рецепторов на поверхности клетки и нарушении регуляции воспалительные (Potempa et al., 2000; Имамура и др., 2003). Они также являются важными дополнительными агентами для роста T. forsythia и A. actinomycetemcomitans в смешанной биопленке с P. gingivalis (Bao et al., 2014; Haraguchi et al., 2014).
Было обнаружено, что гингипаин разрушает фибриноген и белки гема хозяина, которые способствуют ингибированию свертывания крови и увеличивают кровотечение, тем самым повышая доступность гемина для роста бактерий (Sroka et al., 2001).Следовательно, не может быть удивительным обнаружение высокой пролиферации P. gingivalis в пародонтальных карманах, в которых много эритроцитов. Гингипаины также считаются важными по своей способности расщеплять антибактериальные пептиды, такие как нейтрофильные α-дефенсины, факторы комплемента, такие как C3 и C4, рецепторы Т-клеток, такие как CD4 и CD8 (Hajishengallis et al., 2013; Bao et al. др., 2014). Они также снижают экспрессию рецепторов врожденного иммунитета CD14, что приводит к гипореактивности макрофагов к бактериальной инфекции.Однако вопрос о том, связана ли снижение экспрессии CD14 с пародонтитом, вызванным P. gingivalis , требует дальнейшего выяснения. В недавней работе Maekawa et al. (2014), P. gingivalis и его гингипаины, активно манипулируют молекулами хозяина, например, препятствуя перекрестному обмену сигналами между рецептором C5a и толл-подобным рецептором, чтобы предотвратить бактериальный клиренс. Исследования in vitro продемонстрировали, что гингипаины участвуют в регуляции медиаторов воспаления из различных клеток-хозяев, включая IL-1α, IL-1β, IL-18 (Hamedi et al., 2009), рецептор, активируемый протеазой (PAR) -2 (Belibasakis et al., 2010), или растворимый запускающий рецептор, экспрессируемый на миелоидных клетках (sTREM) -1 (Bostanci et al., 2013). Тем не менее, до такой степени нет конкретных доказательств одновременного действия гингипаинов на эти медиаторы воспаления при прогрессировании пародонтита.
Райн, антрахинон из корней ревеня, проявляет антибактериальный синергетический эффект с другими полифенолами. Он вызывает подавление двух генов протеаз, rgpA и kgp, которые связаны с инактивацией защитных механизмов хозяина и разрушением тканей (Azelmat et al., 2015). С другой стороны, теафлавины, основные полифенолы в черном чае, заметно ингибируют протеиназную активность гингипаинов P. gingivalis в зависимости от дозы (Kong et al., 2015). Синтетический двойной ингибитор протеазы, названный KYT-41, был синтезирован, и было обнаружено, что он обладает сильной антибактериальной активностью против P. gingivalis . Этот двойной ингибитор протеаз Rgp и Kgp проявляет противовоспалительную активность, поэтому считается многообещающим средством для профилактики и лечения гингивита (Kataoka et al., 2014).
Белки внешней мембраны
Клеточная оболочка грамотрицательных бактерий, таких как Porphyromonas sp. состоит из двух клеточных мембран, внешней мембраны (OM) и внутренней мембраны (IM). Оба слоя мембран имеют разный состав и структуру. Они разделены периплазмой, содержащей слой пептидогликана. В то время как IM представляет собой бислой фосфолипидов с многочисленными интегральными белками IM (Bos et al., 2007), OM представляет собой асимметричный бислой, который состоит из фосфолипидов и липополисахаридов во внутреннем и внешнем листках, соответственно.Мембрана бактериальной клетки играет роль селективного барьера, обеспечивающего защиту и позволяющего перемещаться различным веществам через пориновые белки ОМ (Nikaido, 2003). Белки OM обычно делятся на две категории: липопротеины OM, которые прикреплены к OM с помощью N-концевого липидного хвоста, и другие интегральные белки OM, которые содержат области, пронизывающие мембраны (Bos and Tommassen, 2004).
ОМ участвует в большинстве специфических процессов распознавания, так как это наиболее уязвимая область бактериальной клетки.Поскольку в области OM существует относительно немного основных белков, ожидается, что эти белки будут важными антигенами для хозяина. Постулируется, что образование и поддержание пародонтальных биопленок связано с взаимодействием между пародонтальной микрофлорой, которое опосредуется белками OM (Bos et al., 2007). Имеются данные о том, что Т-хелперные клетки пациентов с агрессивным пародонтитом, активированные белками P. gingivalis OM, продуцируют более высокие уровни провоспалительных цитокинов, таких как IL-1β и IL-6, по сравнению со здоровыми контрольными людьми (Gonzales et al., 2014).
Анализ белков, экстрагированных из ОМ с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE), показал, что ОМ состоит из разнообразного набора белков размером от 20 до более 100 кДа. Наиболее часто встречающимися белками OM являются порины и OmpA-подобные белки (Bos et al., 2007). Однако до недавнего времени исследования основных белков OM в P. gingivalis оставались недостаточными из-за гидрофобной природы белков. Было сделано несколько попыток охарактеризовать белки OM с использованием различных методов солюбилизации (Yoshimura et al., 2009).
Одно из самых ранних исследований выполнено Yoshimura et al. (1989), в котором был успешно очищен главный ОМ-белок массой 75 кДа, существующий в виде высокомолекулярного олигомера. Этот белок был продемонстрирован Watanabe et al. (1992), чтобы стимулировать активацию поликлональных B-клеток и продукцию IL-1 из перитонеальных макрофагов мыши.
С другой стороны, Saito et al. (1997) сообщили, что ОМ-белок массой 40 кДа из P. gingivalis является важным фактором агрегации на поверхности клетки.В этом исследовании антитело против белка ингибировало активность агрегации клеток P. gingivalis по отношению к A. viscosus , которая является одним из пионеров колонизации поверхности зубов. Этот ОМ-белок массой 40 кДа обнаружен во многих штаммах P. gingivalis , располагаясь как на поверхности клетки, так и во внеклеточных пузырьках. Чрескожная иммунизация мышей ОМ-белком 40 кДа вызвала повышение уровня антител IgG, которые ингибировали коагрегацию P.gingivalis пузырьков (Maeba et al., 2005). В последние годы в исследованиях на животных моделях Zhang et al. (2009) и Liu et al. (2010) было продемонстрировано, что вакцинация мышей ОМ-белком 40 кДа из P. gingivalis вызывает значительное снижение потери альвеолярной кости.
ОМ-белок массой 40 кДа также является гемин-связывающим белком (Shibata et al., 2003). Между тем, назальная иммунизация с использованием белка OM 40 кДа плюс холерный токсин вызывает защитный иммунный ответ против P. gingivalis как у молодых, так и у старых мышей, помимо предотвращения атеросклероза (Koizumi et al., 2008; Cai et al., 2013). В совокупности результаты предполагают, что назальная доставка белка OM может быть потенциальной стратегией вакцины для обеспечения защитного иммунитета человека и, следовательно, профилактики пародонтита.
Кроме того, сравнивались профили белков OM P. gingivalis ATCC 33277 и W83, и было обнаружено, что оба штамма обладают большинством белков OM, таких как RagA, RagB и OmpA-подобных белков, с аналогичным характером распределения ( Имаи и др., 2005). Эти данные, полученные с помощью иммуноблоттинга, позволяют предположить, что эти белки OM представляют собой поверхностные иммунореактивные антигены, но перекрестно реагируют с другими P.gingivalis , должны быть приняты во внимание штаммы.
Согласно Chen et al. (2011) было обнаружено, что белок ОМ, LptO (PG0027) необходим для деацилирования O LPS P. gingivalis , и постулируется, что такое структурное образование необходимо для обеспечения прикрепления к клеткам-хозяевам. Он также играет важную роль в секреции гингипаина на поверхность клеток. С помощью синего нативного PAGE-анализа LptO был обнаружен в составе комплексов до семи различных размеров, и он взаимодействовал с другим белковым комплексом, PG0026, при секреции белков С-концевого домена (Glew et al., 2014; Сайки и Кониши, 2014). Кроме того, было обнаружено, что новый белок OM, названный PG534, играет важную роль в производстве активных гингипаинов (Saiki and Konishi, 2010). Активность гингипаинов R (RgpA и RgpB) и гингипаина K (Kgp) в P. gingivalis с дефектным белком PG534 была снижена по сравнению с его штаммом дикого типа.
Также проводятся исследования по ослаблению действия белков ОМ P. gingivalis . Например, исследования природных экстрактов растений, таких как полифенолы Myrothamnus flabellifolia , показали, что они снижают уровень P.gingivalis адгезия и инвазия до примерно 50% за счет взаимодействия с бактериальными белками ОМ. Такой антиадгезивный эффект также сопровождается цитопротекторным действием, связанным с секрецией цитокинов (Löhr et al., 2011). Однако следует отметить, что этот растительный экстракт был протестирован только на белках OM, но не на других компонентах вирулентности P. gingivalis .
Заключение
В совокупности P. gingivalis является основным этиологическим фактором развития хронического пародонтита.Было обнаружено, что этот вторичный колонизатор экспрессирует множество факторов вирулентности, участвующих в колонизации поддесневого налета и модуляции иммунных ответов клеток-хозяев. Чтобы увеличить выживаемость в организме хозяина, P. gingivalis способен локально вторгаться в ткань периондонта, тем самым избегая иммунного надзора, сохраняя при этом свою жизнеспособность. Каждый фактор вирулентности играет важную роль в препятствовании клеточно-опосредованному иммунному ответу хозяина. Тем не менее, несмотря на убедительные данные, представленные в этом исследовании, следует предупредить, что в реальной ситуации in vivo бактерии экспрессируют целый набор факторов вирулентности, которые могут взаимодействовать и стимулировать клетки-хозяева иначе, чем бактерии. единичный фактор вирулентности.Кроме того, заболевания пародонта редко возникают в результате действия отдельных бактерий. Следовательно, P. gingivalis , вероятно, будет работать с другой микробиотой полости рта, чтобы процветать в тяжелых воспалительных условиях в пародонтальном кармане.
На сегодняшний день было проведено множество исследований для выяснения механизма вирулентности соединений, секретируемых P. gingivalis , и клеточного взаимодействия с хозяином. Лучшее понимание взаимодействия между пародонтальными бактериями и клетками-хозяевами на молекулярном и клеточном уровне может в конечном итоге иметь отношение к общему благополучию хозяина.В последние годы использование натуральных соединений привлекло больше внимания для ослабления действия P. gingivalis . Натуральные продукты растительного происхождения широко используются в качестве терапевтических средств для регулирования взаимодействий между микроорганизмами. Одним из привлекательных терапевтических свойств является то, что биологически активные соединения растений безопасны и не должны вызывать токсичность по отношению к клеткам человека. Тем не менее, всесторонние исследования токсичности этих соединений по-прежнему считаются необходимыми.
Благодаря огромному прогрессу в биомедицинских исследованиях мы надеемся в конечном итоге выяснить возможный уникальный механизм действия P.gingivalis и его детерминанты вирулентности. Исследования в этой области помогут в разработке эффективных методов лечения бактериальной деструкции соединительной ткани. Эти терапевтические подходы могут быть важны в борьбе с хроническими инфекциями P. gingivalis , предотвращая рост и колонизацию P. gingivalis .
Вклад авторов
KH проанализировал литературу и написал статью, KS и KC отредактировали и одобрили рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантами на высокоэффективные исследования Университета Малайи (UM C / 625/1 / HIR / MOHE / CHAN / 01, A-000001-50001 и UM C / 625/1 / HIR / MOHE / CHAN / 14/1, H-50001-A000027) присужден KC.
Ссылки
- Aas J.А., Пастер Б. Дж., Стокс Л. Н., Олсен И., Дьюхерст Ф. Э. (2005). Определение нормальной бактериальной флоры полости рта. J. Clin. Microbiol. 43 год 5721–5732. 10.1128 / JCM.43.11.5721-5732.2005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Али Р. В., Велческу К., Дживанеску М. К., Лофтус Б., Скауг Н. (1996). Распространенность 6 предполагаемых патогенов пародонта в образцах поддесневого налета от взрослых пациентов с пародонтитом в Румынии. J. Clin. Пародонтол. 23 133–139.10.1111 / j.1600-051X.1996.tb00546.x [PubMed] [CrossRef] [Google Scholar]
- Али Т., Абидин К. З. (2012). Связь заболеваний пародонта с недоношенными новорожденными с низкой массой тела в выбранной популяции — проспективное исследование. Общественная вмятина. Здоровье 29 100–105. [PubMed] [Google Scholar]
- Аль-Кутуб М. Н., Брахам П. Х., Карими-Насер Л. М., Лю Х., Дженко К. А., Дарво Р. П. (2006). Гемин-зависимая модуляция структуры липида А липополисахарида Porphyromonas gingivalis . Заражение. Иммун. 74 4474–4485. 10.1128 / IAI.01924-05 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2007). Нарушение эпителиального барьера и нарушение клеточной функции Porphyromonas gingivalis . Фронт. Biosci. 12: 3965–3974. 10.2741 / 2363 [PubMed] [CrossRef] [Google Scholar]
- Амано А. (2010). Бактериальные адгезии к компонентам хозяина при пародонтите. Пародонтология 2000 г. 12–37. 10.1111 / j.1600-0757.2009.00307.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Накагава И., Окахаши Н., Хамада Н. (2004). Вариации фимбрий Porphyromonas gingivalis в зависимости от микробного патогенеза. J. Пародонтология. Res. 39 136–142. 10.1111 / j.1600-0765.2004.00719.x [PubMed] [CrossRef] [Google Scholar]
- Амано А., Такеучи Х., Фурута Н. (2010). Везикулы наружной мембраны действуют как наступательное оружие во взаимодействиях паразит-хозяин. Microbes Infect. 12 791–798.10.1016 / j.micinf.2010.05.008 [PubMed] [CrossRef] [Google Scholar]
- Андриан Э., Гренье Д., Руабиа М. (2004). Модели проникновения и разрушения тканей in vitro с помощью Porphyromonas gingivalis . Заражение. Иммун. 72 4689–4698. 10.1128 / IAI.72.8.4689-4698.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Азельмат Дж., Ларенте Дж. Ф., Гренье Д. (2015). Антрахиноновый реин проявляет синергетическую антибактериальную активность в сочетании с метронидазолом или природными соединениями и снижает экспрессию гена вирулентности в Porphyromonas gingivalis . Arch. Oral Biol. 60 342–346. 10.1016 / j.archoralbio.2014.11.006 [PubMed] [CrossRef] [Google Scholar]
- Бэк К. Дж., Джи С., Ким И. С., Чой Ю. (2015). Связь инвазионной способности Porphyromonas gingivalis с тяжестью пародонтита. Вирулентность 6 274–281. 10.1080 / 21505594.2014.1000764 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бейнбридж Б. В., Хирано Т., Гришабер Н., Дэйви М. Э. (2015). Удаление инвертированного повторяющегося элемента из 77 пар оснований изменяет синтез поверхностных полисахаридов в Porphyromonas gingivalis . J. Bacteriol. 197 1208–1220. 10.1128 / JB.02589-14 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bao K., Belibasakis GN, Thurnheer T., Aduse-Opoku J., Curtis MA, Bostanci N. (2014) . Роль Porphyromonas gingivalis gingipains в формировании многовидовых биопленок. BMC Microbiol. 14: 258 10.1186 / s12866-014-0258-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бартольд П. М., Нараянан А. С. (2006). Молекулярная и клеточная биология здоровых и больных тканей пародонта. Пародонтология 2000 г. 29–49. 10.1111 / j.1600-0757.2005.00140.x [PubMed] [CrossRef] [Google Scholar]
- Бек Дж., Гарсия Р., Хейсс Г., Воконас П. С., Оффенбахер С. (1996). Заболевания пародонта и сердечно-сосудистые заболевания. J. Periodontol. 67 1123–1137. 10.1902 / jop.1996.67.10.1123 [PubMed] [CrossRef] [Google Scholar]
- Белибасакис Г. Н., Бостанси Н., Редди Д. (2010). Регулирование экспрессии активируемого протеазой рецептора-2 в фибробластах десен и Т-клетках Jurkat с помощью Porphyromonas gingivalis . Cell Biol. Int. 34
287–292. 10.1042 / CBI200
[PubMed] [CrossRef] [Google Scholar]
- Боде К., Чандад Ф., Гренье Д. (2006). [Патогенный потенциал Porphyromonas gingivalis, Treponema denticola и Tannerella forsythia , красного бактериального комплекса, связанного с пародонтитом]. Патол.-биол. 55 154–162. 10.1016 / j.patbio.2006.07.045 [PubMed] [CrossRef] [Google Scholar]
- Бос М. П., Роберт В., Томмассен Дж. (2007). Биогенез внешней мембраны грамотрицательных бактерий. Annu. Rev. Microbiol. 61 191–214. 10.1146 / annurev.micro.61.080706.0 [PubMed] [CrossRef] [Google Scholar]
- Bos M. P., Tommassen J. (2004). Биогенез внешней мембраны грамотрицательных бактерий. Curr. Opin. Microbiol. 7 610–616. 10.1016 / j.mib.2004.10.011 [PubMed] [CrossRef] [Google Scholar]
- Бостанци Н., Белибасакис Г. Н. (2012). Porphyromonas gingivalis : инвазивный и ускользающий оппортунистический оральный патоген. FEMS Microbiol.Lett. 333 1–9. 10.1111 / j.1574-6968.2012.02579.x [PubMed] [CrossRef] [Google Scholar]
- Бостанси Н., Турнхеер Т., Адусе-Опоку Дж., Кертис М. А., Зинкернагель А. С., Белибасакис Г. Н. (2013). Porphyromonas gingivalis регулирует TREM-1 в полиморфно-ядерных нейтрофилах человека через гингипаины. PLoS ONE 8: e75784 10.1371 / journal.pone.0075784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бруннер Дж., Шерес Н., Эль Идрисси Н. Б., Дэн Д.М., Лайне М. Л., ван Винкельхофф А. Дж. И др. (2010). Капсула Porphyromonas gingivalis снижает иммунный ответ фибробластов десен человека. BMC Microbiol. 10: 5 10.1186 / 1471-2180-10-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Cai Y., Kurita-Ochiai T., Kobayashi R., Hashizume T., Yamamoto M. (2013) . Назальная иммунизация белком внешней мембраны 40 кДа Porphyromonas gingivalis плюс холерный токсин индуцирует защитный иммунитет у старых мышей. J. Oral Sci. 55 107–114. 10.2334 / josnusd.55.107 [PubMed] [CrossRef] [Google Scholar]
- Касарин Р. К., Дель Пелосо Рибейро Э., Мариано Ф. С., Носити Ф. Х., младший, Казати М. З., Гонсалвес Р. Б. (2010). Уровни Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis , воспалительных цитокинов и видоспецифического иммуноглобулина G при генерализованном агрессивном и хроническом пародонтите. J. Periodont. Res. 45 635–642. 10.1111 / j.1600-0765.2010.01278.x [PubMed] [CrossRef] [Google Scholar]
- Чен Ю., Пэн Б., Ян К., Глю М. Д., Вейт П. Д., Кросс К. Дж. и др. (2011). Белок внешней мембраны LptO необходим для O-деацилирования LPS и координированной секреции и прикрепления белков A-LPS и CTD в Porphyromonas gingivalis . Мол. Microbiol. 79 1380–1401. 10.1111 / j.1365-2958.2010.07530.x [PubMed] [CrossRef] [Google Scholar]
- Ci X., Chen L., Ou X. (2015). Экстракты проантоцианидинов виноградных косточек ингибируют липополисахарид Porphyromonas gingivalis . Shanghai J. Stomatol. 24 433–436. [PubMed] [Google Scholar]
- Curtis M., Aduse-Opoku J., Rangarajan M. (2001). Цистеиновые протеазы Porphyromonas gingivalis . Crit. Rev. Oral Biol. Med. 12 192–216. 10.1177 / 10454411010120030101 [PubMed] [CrossRef] [Google Scholar]
- Дарво Р. П., Белтон К. М., Райф Р. А., Ламонт Р. Дж. (1998). Местный хемокиновый паралич, новый патогенетический механизм Porphyromonas gingivalis . Заражение.Иммун. 66 1660–1665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Дарво Р. П., Фам Т.-Т. Т., Лемли К., Райфе Р. А., Бейнбридж Б. В., Коутс С. Р. и др. (2004). Porphyromonas gingivalis липополисахарид содержит несколько видов липидов A, которые функционально взаимодействуют с обоими toll-подобными рецепторами 2 и 4. Заражение. Иммун. 72 5041–5051. 10.1128 / IAI.72.9.5041-5051.2004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Датта Х. К., Нг В. Ф., Уокер Дж. А., Так С. П., Варанаси С. С. (2008). Клеточная биология костного метаболизма. J. Clin. Патол. 61 577–587. 10.1136 / jcp.2007.048868 [PubMed] [CrossRef] [Google Scholar]
- de Diego I., Veillard F., Sztukowska M. N., Guevara T., Potempa B., Pomowski A., et al. (2014). Структура и механизм цистеинпептидазы Gingipain K (Kgp), основного фактора вирулентности Porphyromonas gingivalis при пародонтите. J. Biol. Chem. 289 32291–32302.10.1074 / jbc.M114.602052 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- ДеЛеон-Пеннелл К. Ю., де Кастро Брас Л. Э., Линдси М. Л. (2013). Циркулирующий липополисахарид Porphyromonas gingivalis сбрасывает сердечный гомеостаз у мышей посредством механизма, зависимого от матриксной металлопротеиназы-9. Physiol. Репутация 1: e00079 10.1002 / phy2.79 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дерраджиа А., Аланази Х., Пак Х. Дж., Джериби Р., Семлали А., Руабия М. (2015). α-токоферол снижает уровень интерлейкинов-1β и -6 и увеличивает секрецию β-дефенсинов-1 и -2 человека в фибробластах десен человека, стимулированных липополисахаридом Porphyromonas gingivalis . J. Periodontal Res. 10.1111 / jre.12308 [Epub перед печатью]. [PubMed] [CrossRef] [Google Scholar]
- Диас Л., Хоар А., Сото К., Бугеньо И., Сильва Н., Дутзан Н. и др. (2015). Изменения липополисахаридного профиля клинических изолятов Porphyromonas gingivalis коррелируют с изменениями морфологии колоний и устойчивости к полимиксину B. Анаэроб 33 25–32. 10.1016 / j.anaerobe.2015.01.009 [PubMed] [CrossRef] [Google Scholar]
- Dierickx K., Pauwels M., Laine M. L., Van Eldere J., Cassiman J. J., van Winkelhoff A. J. и др. (2003). Адгезия серотипов Porphyromonas gingivalis к эпителию кармана. J. Periodontol. 74 844–848. 10.1902 / jop.2003.74.6.844 [PubMed] [CrossRef] [Google Scholar]
- Дорн Б. Р., Беркс Дж. Н., Зейферт К. Н., Прогульске-Фокс А. (2000). Инвазия эндотелиальных и эпителиальных клеток штаммом Porphyromonas gingivalis . FEMS Microbiol. Lett. 187 139–144. 10.1111 / j.1574-6968.2000.tb09150.x [PubMed] [CrossRef] [Google Scholar]
- Dubin G., Koziel J., Pyrc K., Wladyka B., Potempa J. (2013). Бактериальные протеазы в заболевании — роль во внутриклеточном выживании, уклонении от свертывания / фибринолиза, врожденных защитных сил, токсикозов и вирусных инфекций. Curr. Pharm. Des. 19 1090–1113. 10.2174 / 13816128113111 [PubMed] [CrossRef] [Google Scholar]
- Элоэ-Фадрош Э. А., Раско Д. А. (2013).Микробиом человека: от симбиоза к патогенезу. Annu. Rev. Med. 64 145–163. 10.1146 / annurev-med-010312-133513 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Friedewald V. E., Kornman K. S., Beck J. D., Genco R., Goldfine A., Libby P., et al. (2009). Американский кардиологический журнал и консенсус редакторов журнала пародонтологии: пародонтит и атеросклеротическое сердечно-сосудистое заболевание. Am. J. Cardiol. 104 59–68. 10.1016 / j.amjcard.2009.05.002 [PubMed] [CrossRef] [Google Scholar]
- Fujiwara T., Morishima S., Takahashi I., Hamada S. (1993). Молекулярное клонирование и секвенирование гена фимбрилина штаммов Porphyromonas gingivalis и характеристика рекомбинантных белков. Biochem. Биофиз. Res. Commun. 197 241–247. 10.1006 / bbrc.1993.2467 [PubMed] [CrossRef] [Google Scholar]
- Дженко Р. Дж., Боргнакке В. С. (2013). Факторы риска заболеваний пародонта. Пародонтология 2000 г. 59–94.10.1111 / j.1600-0757.2012.00457.x [PubMed] [CrossRef] [Google Scholar]
- Glew M. D., Veith P. D., Chen D., Seers C. A., Chen Y.-Y., Reynolds E. C. (2014). Голубой нативный ПААГ-анализ комплексов мембранных белков в Porphyromonas gingivalis . J. Proteomics 110 72–92. 10.1016 / j.jprot.2014.07.033 [PubMed] [CrossRef] [Google Scholar]
- Гокю М., Кобаяши Х., Нанбара Х., Судо Т., Икеда Й., Суда Т. и др. (2014). Продукция тромбоспондина-1 усиливается липополисахаридом Porphyromonas gingivalis в клетках THP-1. PLoS ONE 9: e115107 10.1371 / journal.pone.0115107 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gonzales J., Groeger S., Johansson A., Meyle J. (2014). Т-хелперы от пациентов с агрессивным пародонтитом производят более высокие уровни интерлейкина-1 бета и интерлейкина-6 во взаимодействии с Porphyromonas gingivalis . Clin. Устное расследование. 18 1835–1843 гг. 10.1007 / s00784-013-1162-5 [PubMed] [CrossRef] [Google Scholar]
- Haffajee A. D., Сокранский С.С. (1994). Микробные этиологические агенты деструктивных заболеваний пародонта. Пародонтология 2000 г. 78–111. 10.1111 / j.1600-0757.1994.tb00020.x [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Абэ Т., Маэкава Т., Хаджишенгаллис Э., Ламбрис Дж. Д. (2013). Роль комплемента в гомеостазе пародонта микробами-хозяевами. Семин. Иммунол. (Эльзевьер) 25 65–72. 10.1016 / j.smim.2013.04.004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Дарво Р. П., Кертис М. А. (2012). Гипотеза краеугольного камня. Nat. Rev. Microbiol. 10 717–725. 10.1038 / nrmicro2873 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хаджишенгаллис Г., Ламонт Р. Дж. (2014). Во все тяжкие: манипулирование реакцией хозяина с помощью Porphyromonas gingivalis . Eur. J. Immunol. 44 год 328–338. 10.1002 / eji.201344202 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Hajishengallis G., Wang M., Liang S., Триантафилу М., Триантафилу К. (2008). Патогенетическая индукция перекрестных помех CXCR4 / TLR2 нарушает защитную функцию хозяина. Proc. Natl. Акад. Sci. США 105 13532–13537. 10.1073 / pnas.0803852105 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хамада Н., Ватанабе К., Сасакава К., Йошикава М., Йошимура Ф., Умемото Т. (1994). Конструирование и характеристика мутанта fimA Porphyromonas gingivalis . Заражение. Иммун. 62 1696–1704. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hamedi M., Белибасакис Г., Кручли А., Рангараджан М., Кертис М., Бостанси Н. (2009). Porphyromonas gingivalis Супернатанты культур по-разному регулируют интерлейкин-1β и интерлейкин-18 в моноцитарных клетках человека. Цитокин 45 99–104. 10.1016 / j.cyto.2008.11.005 [PubMed] [CrossRef] [Google Scholar]
- Хэндли П. С., Типлер Л. С. (1986). Исследование поверхностных структур и гидрофобности оральных и неоральных видов бактерий рода Bacteroides под электронным микроскопом. Arch. Oral Biol. 31 год 325–335. 10.1016 / 0003-9969 (86) -6 [PubMed] [CrossRef] [Google Scholar]
- Харагути А., Миура М., Фудзисе О., Хамачи Т., Нисимура Ф. (2014). Porphyromonas gingivalis гингипаин участвует в отслоении и агрегации биопленки Aggregatibacter actinomycetemcomitans . Мол. Oral Microbiol. 29 131–143. 10.1111 / omi.12051 [PubMed] [CrossRef] [Google Scholar]
- Хаяси С., Ямада Х., Фукуи М., Ито Х.-О., Сата М. (2015). Корреляция между артериосклерозом и состоянием пародонта, оцениваемая по уровням лактоферрина и α1-антитрипсина в десневой щелевой жидкости. Внутр. Сердце J. 56 639–643. 10.1536 / ihj.15-218 [PubMed] [CrossRef] [Google Scholar]
- Херат Т. Д. К., Ван Й., Сеневиратн К. Дж., Дарво Р. П., Ван С. Й., Джин Л. Дж. (2011). Гетерогенный LPS Porphyromonas gingivalis по-разному модулирует врожденный иммунный ответ десны человека. BMC Proc. 5:86 10.1186 / 1753-6561-5-s1-p86 [CrossRef] [Google Scholar]
- Herzberg M. C., Meyer M. W. (1996). Влияние флоры полости рта на тромбоциты: возможные последствия при сердечно-сосудистых заболеваниях. J. Periodontol. 67 1138–1142. 10.1902 / jop.1996.67.10s.1138 [PubMed] [CrossRef] [Google Scholar]
- Холт С. К., Кесавалу Л., Уокер С., Дженко К. А. (1999). Факторы вирулентности Porphyromonas gingivalis . Пародонтология 2000 г. 168–238. 10.1111 / j.1600-0757.1999.tb00162.x [PubMed] [CrossRef] [Google Scholar]
- Игбоин К. О., Тордофф К. П., Мешбергер М. Л., Гриффен А. Л., Лейс Э. Дж. (2011). Porphyromonas gingivalis -хостовые взаимодействия в модели Drosophila melanogaster . Заражение. Иммун. 79 449–458. 10.1128 / IAI.00785-10 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Имаи М., Мураками Ю., Нагано К., Накамура Х., Йошимура Ф. (2005). Основные белки внешней мембраны из Porphyromonas gingivalis : изменение штамма, распределение и клиническое значение при перирадикулярных поражениях. Eur. J. Oral Sci. 113 391–399. 10.1111 / j.1600-0722.2005.00235.x [PubMed] [CrossRef] [Google Scholar]
- Имамура Т., Трэвис Дж., Потемпа Дж. (2003). Двухфазная вирулентная активность гингипаинов: активация и инактивация белков хозяина. Curr. Protein Pept. Sci. 4
443–450. 10.2174 / 138
33487027 [PubMed] [CrossRef] [Google Scholar]
- Иршад М., ван дер Рейден В. А., Крилаард В., Лейн М. Л. (2012). Инвазия и выживаемость Porphyromonas gingivalis in vitro в фибробластах десен; роль капсулы. Arch. Иммунол. Ther. Exp. 60 469–476. 10.1007 / s00005-012-0196-8 [PubMed] [CrossRef] [Google Scholar]
- Джейн С., Дарво Р. П. (2010). Вклад липополисахарида Porphyromonas gingivalis в пародонтит. Пародонтология 2000 г. 53–70. 10.1111 / j.1600-0757.2009.00333.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дженкинсон Х. Ф., Ламонт Р. Дж. (2006). «Микробная экология полости рта», в Микробиология и иммунология полости рта редакторы Ламонт Р.Дж., Берн Р. А., Ланц М. С., Леблан Д. Дж. (Вашингтон, округ Колумбия: ASM Press;). [Google Scholar]
- Jian C.-X., Li M.-Z., Zheng W.-Y., He Y., Ren Y., Wu Z.-M., et al. (2015). Торментиновая кислота подавляет LPS-индуцированный воспалительный ответ в фибробластах десен человека посредством ингибирования TLR4-опосредованного сигнального пути NF-κB и MAPKs. Arch. Oral Biol. 60 1327–1332. 10.1016 / j.archoralbio.2015.05.005 [PubMed] [CrossRef] [Google Scholar]
- Катаока С., Баба А., Суда Ю., Такий Р., Хашимото М., Кавакубо Т. и др. (2014). Новый мощный двойной ингибитор аргингипаинов и лизингипаинов в качестве многообещающего средства для лечения заболеваний пародонта. FASEB J. 28 год 3564–3578. 10.1096 / fj.14-252130 [PubMed] [CrossRef] [Google Scholar]
- Като Х., Тагучи Ю., Томинага К., Умеда М., Танака А. (2014). Porphyromonas gingivalis LPS подавляет дифференцировку остеобластов и способствует выработке провоспалительных цитокинов в стволовых клетках пародонтальной связки человека. Arch. Oral Biol. 59 167–175. 10.1016 / j.archoralbio.2013.11.008 [PubMed] [CrossRef] [Google Scholar]
- Кац Дж., Уорд Д., Михалек С. (1996). Влияние ответов хозяина на патогенность штаммов Porphyromonas gingivalis . Oral Microbiol. Иммунол. 11 309–318. 10.1111 / j.1399-302X.1996.tb00187.x [PubMed] [CrossRef] [Google Scholar]
- Коидзуми Ю., Курита-Очиаи Т., Огучи С., Ямамото М. (2008). Назальная иммунизация белком внешней мембраны Porphyromonas gingivalis снижает количество P.gingivalis -индуцированный атеросклероз и воспаление у мышей со спонтанной гиперлипидемией. Заражение. Иммун. 76 2958–2965. 10.1128 / IAI.01572-07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Komatsu T. (2014). «Окислительный стресс и заболевания пародонта при синдроме Дауна», в Исследования заболеваний пародонта редакторы Экуни Д., Баттино М., Томофуджи Т., Путнинс Э. Э. (Берлин: Springer;) 211–223. [Google Scholar]
- Kong L., Qi X., Huang S., Chen S., Ву Ю., Чжао Л. (2015). Теафлавины подавляют патогенные свойства P. gingivalis и продукцию ММП в P. gingivalis -стимулированных фибробластах десен человека. Arch. Oral Biol. 60 12–22. 10.1016 / j.archoralbio.2014.08.019 [PubMed] [CrossRef] [Google Scholar]
- Кристофферсен А. К., Солли С. Дж., Нгуен Т. Д., Энерсен М. (2015). Ассоциация генотипа гингипаина rgpB с генотипом основных фимбрий (fimA) в клинических изолятах пародонтального патогена Porphyromonas gingivalis . J. Oral Microbiol. 7: 29124 10.3402 / jom.v7.29124 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kuramitsu H. K., Qi M., Kang I.-C., Chen W. (2001). Роль пародонтальных бактерий в сердечно-сосудистых заболеваниях. Ann. Пародонтол. 6 41–47. 10.1902 / annals.2001.6.1.41 [PubMed] [CrossRef] [Google Scholar]
- Лейн М. Л., Аппельмелк Б. Дж., Ван Винкельхофф А. Дж. (1997). Распространенность и распределение шести капсульных серотипов Porphyromonas gingivalis у пациентов с пародонтитом. J. Dent. Res. 76 1840–1844 гг. 10.1177 / 00220345970760120601 [PubMed] [CrossRef] [Google Scholar]
- Ли Дж. Й., Соджар Х. Т., Беди Г. С., Дженко Р. Дж. (1992). Синтетические пептиды, аналогичные последовательности фимбриллина, ингибируют адгезию Porphyromonas gingivalis . Заражение. Иммун. 60 1662–1670. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лю К., Хашизуме Т., Курита-Очиай Т., Фуджихаши К., Ямамото М. (2010). Оральная иммунизация с использованием белка внешней мембраны Porphyromonas gingivalis и CpGoligodeoxynucleotides вырабатывает цитокины T-хелперов 1 и 2 для усиления защитного иммунитета. Мол. Oral Microbiol. 25 178–189. 10.1111 / j.2041-1014.2009.00560.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Лю Р., Деста Т., Раптис М., Дарво Р. П., Грейвс Д. Т. (2008). Липополисахариды P. gingivalis и E. coli демонстрируют разную системную, но схожую локальную индукцию маркеров воспаления. J. Periodontol. 79 1241–1247. 10.1902 / jop.2008.070575 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lockhart P.Б., Болджер А. Ф., Папапану П. Н., Осинбовале О., Тревизан М., Левисон М. Э. и др. (2012). Заболевания пародонта и атеросклеротическое заболевание сосудов: подтверждают ли данные независимую связь? Научное заявление Американской кардиологической ассоциации. Тираж 125 2520–2544. 10.1161 / CIR.0b013e31825719f3 [PubMed] [CrossRef] [Google Scholar]
- Лёр Г., Бейклер Т., Подбельски А., Стандарт К., Реданц С., Хенсель А. (2011). Полифенолы Myrothamnus flabellifolia Welw.подавляют адгезию in vitro Porphyromonas gingivalis и оказывают противовоспалительное цитопротекторное действие на клетки KB. J. Clin. Пародонтол. 38 457–469. 10.1111 / j.1600-051X.2010.01654.x [PubMed] [CrossRef] [Google Scholar]
- Мадианос П. Н., Бобетсис Ю. А., Оффенбахер С. (2013). Неблагоприятные исходы беременности (АПО) и заболевания пародонта: патогенетические механизмы. J. Clin. Пародонтол. 40 S170 – S180. 10.1111 / jcpe.12082 [PubMed] [CrossRef] [Google Scholar]
- Maeba S., Отаке С., Намикоши Дж., Сибата Ю., Хаякава М., Абико Ю. и др. (2005). Чрескожная иммунизация 40 кДа белком внешней мембраны Porphyromonas gingivalis индуцирует специфические антитела, которые ингибируют коагрегацию с помощью P. gingivalis . Вакцина 23 2513–2521. 10.1016 / j.vaccine.2004.10.036 [PubMed] [CrossRef] [Google Scholar]
- Маэда К., Триббл Г. Д., Такер К. М., Аная К., Сидзукуиси С., Льюис Дж. П. и др. (2008). Тирозинфосфатаза Porphyromonas gingivalis является многофункциональным регулятором признаков вирулентности. Мол. Microbiol. 69 1153–1164. 10.1111 / j.1365-2958.2008.06338.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Maekawa T., Krauss JL, Abe T., Jotwani R., Triantafilou M., Triantafilou K. , и другие. (2014). Porphyromonas gingivalis манипулирует передачей сигналов комплемента и TLR, чтобы отделить бактериальный клиренс от воспаления и способствовать дисбактериозу. Клеточный микроб-хозяин 15 768–778. 10.1016 / j.chom.2014.05.012 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mahanonda R., Сеймур Г. Дж., Пауэлл Л. В., Гуд М. Ф., Холлидей Дж. У. (1991). Влияние начального лечения хронического воспалительного заболевания пародонта на частоту Т-лимфоцитов периферической крови, специфичных для пародонтопатических бактерий. Oral Microbiol. Иммунол. 6 221–227. 10.1111 / j.1399-302X.1991.tb00481.x [PubMed] [CrossRef] [Google Scholar]
- Maiden M. F., Cohee P., Tanner A. C. (2003). Предложение сохранить форму прилагательного специфического эпитета при реклассификации Bacteroides forsythus Tanner et al .1986 к роду Tannerella Sakamoto et al . 2002 как Tannerella forsythia corrig., Gen. ноя, гребешок. ноя Запрос заключения. Внутр. J. Syst. Evol. Microbiol. 53 2111–2112. 10.1099 / ijs.0.02641-0 [PubMed] [CrossRef] [Google Scholar]
- Мантри К. К., Чен К. Х., Дон Х., Гудвин Дж. С., Пратап С., Паромов В. и др. (2015). Фимбрии-опосредованное образование пузырьков внешней мембраны и инвазия Porphyromonas gingivalis . Microbiologyopen 4 53–65.10.1002 / mbo3.221 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Marcotte H., Lavoie M. C. (1998). Микробная экология полости рта и роль иммуноглобулина слюны A. Microbiol. Мол. Биол. Сборка 62 71–109. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Марес К. Дж., Хеллвард А., Срока А., Адамович К., Белецкая Е., Козиль Дж. И др. (2013). Porphyromonas gingivalis способствует развитию и прогрессированию деструктивного артрита благодаря своей уникальной бактериальной пептидиларгининдезиминазе (PAD). PLoS Pathog. 9: e1003627 10.1371 / journal.ppat.1003627 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Mehta A. (2015). Факторы риска, связанные с заболеваниями пародонта, и их клинические аспекты. Внутр. J. Contemp. Вмятина. Med. Сборка 2015 г. 1–15. [Google Scholar]
- Мур У. Э., Мур Л. Х., Рэнни Р., Смиберт Р. М., Бурмейстер Дж. А., Шенкейн Х. А. (1991). Микрофлора участков пародонта показывает активную деструктивную прогрессию. Дж.Clin. Пародонтол. 18 729–739. 10.1111 / j.1600-051X.1991.tb00064.x [PubMed] [CrossRef] [Google Scholar]
- Мур У. Э., Мур Л. В. (1994). Бактерии заболеваний пародонта. Пародонтология 2000 г. 66–77. 10.1111 / j.1600-0757.1994.tb00019.x [PubMed] [CrossRef] [Google Scholar]
- Мураками Ю., Кавата А., Ито С., Катаяма Т., Фудзисава С. (2015). Активность по улавливанию радикалов и цитотоксичность ресвератрола, орцинола и 4-аллилфенола и их ингибирующие эффекты на экспрессию гена cox-2 и активацию Nf-κb в RAW264.7 клеток стимулировали Porphyromonas gingivalis -fimbriae. In Vivo 29 341–349. [PubMed] [Google Scholar]
- На Х., Лим Э., Чон С., Рю М., Пак М., Чунг Дж. (2014). Экспрессия ингибитора активатора плазминогена типа 1, индуцированная липополисахаридом Porphyromonas gingivalis в фибробласте десны человека. J. Microbiol. 52 154–160. 10.1007 / s12275-014-3022-7 [PubMed] [CrossRef] [Google Scholar]
- Nagano K., Hasegawa Y., Yoshida Y., Йошимура Ф. (2015). Главный фимбрилиновый вариант фимбрий Mfa1 в Porphyromonas gingivalis . J. Dent. Res. 94 1143–1148. 10.1177 / 0022034515588275 [PubMed] [CrossRef] [Google Scholar]
- Накано К., Инаба Х., Номура Р., Немото Х., Такеда М., Йошиока Х. и др. (2006). Обнаружение кариесогенного Streptococcus mutans в образцах экстирпированного сердечного клапана и атероматозных бляшек. J. Clin. Microbiol. 44 год 3313–3317. 10.1128 / JCM.00377-06 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Nikaido H.(2003). Пересмотр молекулярных основ проницаемости бактериальной внешней мембраны. Microbiol. Мол. Биол. Сборка 67 593–656. 10.1128 / MMBR.67.4.593-656.2003 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Нисенгард Р. Дж., Ньюман М. Г. (1994). Oral Microbiol Immunol. Филадельфия: W.B. Компания Сондерс. [Google Scholar]
- Оффенбахер С. (1996). Заболевания пародонта: патогенез. Ann. Пародонтол. 1 821–878. 10.1902 / annals.1996.1.1.821 [PubMed] [CrossRef] [Google Scholar]
- Огава Т., Яги Т. (2010). Биоактивный механизм липида A Porphyromonas gingivalis . Пародонтология 2000 г. 71–77. 10.1111 / j.1600-0757.2009.00343.x [PubMed] [CrossRef] [Google Scholar]
- Оливейра Ф. А. Ф., Форте С. П. Ф., Сильва П. Г., Лопес С. Б., Черногория Р. К., Сантос А. К. и др. (2015). Молекулярный анализ бактерий полости рта в сердечном клапане пациентов с сердечно-сосудистыми заболеваниями с помощью полимеразной цепной реакции в реальном времени. Медицина 94: e2067 10.1097 / MD.0000000000002067 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Парахитиява Н.Б., Скалли К., Люнг В. К., Ям В. К., Джин Л. Дж., Самаранаяке Л. П. (2010). Изучение бактериальной флоры полости рта: текущее состояние и будущие направления. Устный дис. 16 136–145. 10.1111 / j.1601-0825.2009.01607.x [PubMed] [CrossRef] [Google Scholar]
- Пастер Б. Дж., Олсен И., Аас Дж. А., Дьюхерст Ф. Э. (2006). Широта бактериального разнообразия в пародонтальном кармане человека и других участках полости рта. Пародонтология 2000 г. 80–87. 10.1111 / j.1600-0757.2006.00174.x [PubMed] [CrossRef] [Google Scholar]
- Pennisi E.(2005). Полный рот микробов. Наука 307 1899–1901. 10.1126 / science.307.5717.1899 [PubMed] [CrossRef] [Google Scholar]
- Петерсен П. Э., Огава Х. (2012). Глобальное бремя заболеваний пародонта: к интеграции с профилактикой хронических заболеваний и борьбой с ними. Пародонтология 2000 г. 15–39. 10.1111 / j.1600-0757.2011.00425.x [PubMed] [CrossRef] [Google Scholar]
- Potempa J., Banbula A., Travis J. (2000). Роль бактериальных протеиназ в разрушении матрикса и модуляции ответов хозяина. Пародонтология 2000 г. 153–192. 10.1034 / j.1600-0757.2000.2240108.x [PubMed] [CrossRef] [Google Scholar]
- Приядаршини Р., Куджини К., Арндт А., Чен Т., Тьокро Н. О., Гудман С. Д. и др. (2013). Связанный с нуклеоидом белок HUβ влияет на глобальную экспрессию генов у Porphyromonas gingivalis . Микробиология 159 219–229. 10.1099 / mic.0.061002-0 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Розен Г., Села М. Н. (2006). Коагрегация Porphyromonas gingivalis и Fusobacterium nucleatum PK 1594 опосредуется капсульным полисахаридом и липополисахаридом. FEMS Microbiol. Lett. 256 304–310. 10.1111 / j.1574-6968.2006.00131.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2010). Идентификация нового белка внешней мембраны Porphyromonas gingivalis , PG534, необходимого для производства активных гингипаинов. FEMS Microbiol. Lett. 310 168–174. 10.1111 / j.1574-6968.2010.02059.x [PubMed] [CrossRef] [Google Scholar]
- Сайки К., Кониси К. (2014). Porphyromonas gingivalis C-концевая сигнальная пептидаза PG0026 и HagA взаимодействуют с белком внешней мембраны PG27 / LptO. Мол. Oral Microbiol. 29 32–44. 10.1111 / omi.12043 [PubMed] [CrossRef] [Google Scholar]
- Сайто С., Хирацука К., Хаякава М., Такигучи Х., Абико Ю. (1997). Ингибирование колонизирующего фактора Porphyromonas gingivalis между Actinomyces viscosus ATCC 19246 с помощью моноклональных антител против рекомбинантного белка внешней мембраны 40 кДа. Gen. Pharmacol. 28 год 675–680. 10.1016 / S0306-3623 (96) 00366-7 [PubMed] [CrossRef] [Google Scholar]
- Сареми А., Нельсон Р. Г., Таллох-Рид М., Хэнсон Р. Л., Сиверс М. Л., Тейлор Г. В. и др. (2005). Заболевания пародонта и смертность при диабете 2 типа. Уход за диабетом 28 год 27–32. 10.2337 / diacare.28.1.27 [PubMed] [CrossRef] [Google Scholar]
- Шмидт Дж., Йенч Х., Стингу К.-С., Сак У. (2014). Общий иммунный статус и микробиология полости рта у пациентов с различными формами пародонтита и здоровых лиц контрольной группы. PLoS ONE 9: e109187 10.1371 / journal.pone.0109187 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шах Х.Н., Коллинз М. Д. (1988). Предложение о реклассификации Bacteroides asaccharolyticus, Bacteroides gingivalis и Bacteroides endodontalis в новый род, Porphyromonas . Внутр. J. Sys. Бактериол. 38 128–131. 10.1099 / 00207713-38-1-128 [CrossRef] [Google Scholar]
- Sharma A., Sojar H. T., Lee J. Y., Genco R.J. (1993). Экспрессия функционального полипептида фимбриллина Porphyromonas gingivalis в Escherichia coli : очистка, физико-химическая и иммунохимическая характеристика и характеристики связывания. Заражение. Иммун. 61 3570–3573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шибата Ю., Хирацука К., Хаякава М., Широза Т., Такигучи Х., Нагацука Ю. и др. (2003). Фактор коагрегации 35 кДа представляет собой гемин-связывающий белок в Porphyromonas gingivalis . Biochem. Биофиз. Res. Commun. 300 351–356. 10.1016 / S0006-291X (02) 02826-7 [PubMed] [CrossRef] [Google Scholar]
- Silhavy T. J., Kahne D., Walker S. (2010). Оболочка бактериальной клетки. Cold Spring Harb. Перспектива. Биол. 2: a000414 10.1101 / cshperspect.a000414 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Singh A., Wyant T., Anaya-Bergman C., Aduse-Opoku J., Brunner J., Laine ML, et. al. (2011). Капсула Porphyromonas gingivalis приводит к снижению воспалительной реакции хозяина, уклонению от фагоцитоза и увеличению вирулентности. Заражение. Иммун. 79 4533–4542. 10.1128 / IAI.05016-11 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Slots J., Брэгд Л., Викстром М., Дален Г. (1986). Встречаемость Actinobacillus actinomycetemcomitans, Bacteroides gingivalis и Bacteroides intermediateus при деструктивных заболеваниях пародонта у взрослых. J. Clin. Пародонтол. 13 570–577. 10.1111 / j.1600-051X.1986.tb00849.x [PubMed] [CrossRef] [Google Scholar]
- Срока А., Штуковска М., Потемпа Дж., Трэвис Дж., Дженко К. А. (2001). Расщепление гемовых белков хозяина лизин- и аргинин-специфическими цистеиновыми протеиназами (гингипаинами) Porphyromonas gingivalis . J. Bacteriol. 183 5609–5616. 10.1128 / JB.183.19.5609-5616.2001 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Таннер А. К., Хаффер К., Браттхолл Г. Т., Висконти Р. А., Сокранский С. С. (1979). Исследование бактерий, вызывающих прогрессирование пародонтита у человека. J. Clin. Пародонтол. 6 278–307. 10.1111 / j.1600-051X.1979.tb01931.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1986). Неспецифическая теория микробной этиологии воспалительных заболеваний пародонта. J. Clin. Пародонтол. 13 905–911. 10.1111 / j.1600-051X.1986.tb01425.x [PubMed] [CrossRef] [Google Scholar]
- Theilade E. (1990). Факторы, контролирующие микрофлору здорового рта человека. Бока-Ратон, Флорида: CRC Press. [Google Scholar]
- Тьокро Н. О., Рокко К. Дж., Приядаршини Р., Дэйви М. Э., Гудман С. Д. (2014). Биохимический анализ взаимодействия белка Porphyromonas gingivalis HU PG0121 с ДНК. PLoS ONE 9: e
10.1371 / journal.pone.00
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Трэвис Дж., Пайк Р., Имамура Т., Потемпа Дж. (1997). Porphyromonas gingivalis протеиназы как факторы вирулентности в развитии пародонтита. J. Пародонтология. Res. 32 120–125. 10.1111 / j.1600-0765.1997.tb01392.x [PubMed] [CrossRef] [Google Scholar]
- Ван Стинберген Т. Дж., Делемар Ф. Г., Намавар Ф., Де Граафф Дж. (1987). Различия в вирулентности между видами Bacteroides gingivalis. Антони Ван Левенгук 53 233–244. 10.1007 / BF003 [PubMed] [CrossRef] [Google Scholar]
- Ватанабэ К., Ямаджи Ю., Умемото Т. (1992). Корреляция между клеточной адгезивной активностью и структурой поверхности у Porphyromonas gingivalis . Oral Microbiol. Иммунол. 7 357–363. 10.1111 / j.1399-302X.1992.tb00636.x [PubMed] [CrossRef] [Google Scholar]
- Wiebe C. B., Putnins E. E. (2000). Система классификации заболеваний пародонта Американской академии пародонтологии — обновление. J. Can. Вмятина. Доц. 66 594–597. [PubMed] [Google Scholar]
- Уильямс К. Э., Давенпорт Э. С., Стерн Дж. А., Сивапатхасундарам В., Ферн Дж. М., Кертис М. А. (2000). Механизмы риска у недоношенных новорожденных с низкой массой тела. Пародонтология 2000 г. 142–150. 10.1034 / j.1600-0757.2000.2230115.x [PubMed] [CrossRef] [Google Scholar]
- Уильямс Р. О., Фельдманн М., Майни Р. Н. (1992). Фактор противоопухолевого некроза облегчает заболевание суставов при артрите, индуцированном коллагеном у мышей. Proc. Natl. Акад. Sci. США 89 9784–9788. 10.1073 / pnas.89.20.9784 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ян Дж., Ву Дж., Лю Ю., Хуанг Дж., Лу З., Се Л. и др. . (2014). Porphyromonas gingivalis Инфекция снижает уровень регуляторных Т-лимфоцитов у инфицированных пациентов с атеросклерозом. PLoS ONE 9: e86599 10.1371 / journal.pone.0086599 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Йемваттана И., Каомонгколгит Р. (2015).Альфа-мангостин подавляет экспрессию IL-6 и IL-8 в P. gingivalis LPS-стимулированных фибробластах десен человека. Стоматология 103 348–355. 10.1007 / s10266-014-0160-7 [PubMed] [CrossRef] [Google Scholar]
- Йошимура А., Хара Ю., Канеко Т., Като И. (1997). Секреция ИЛ-1 бета, ФНО-альфа, ИЛ-8 и ИЛ-1ra полиморфно-ядерными лейкоцитами человека в ответ на липополисахариды пародонтопатических бактерий. J. Periodontal Res. 32 279–286. 10.1111 / j.1600-0765.1997.tb00535.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Мураками Ю., Нисикава К., Хасегава Ю., Каваминами С. (2009). Компоненты поверхности Porphyromonas gingivalis . J. Periodontal Res. 44 год 1–12. 10.1111 / j.1600-0765.2008.01135.x [PubMed] [CrossRef] [Google Scholar]
- Йошимура Ф., Ватанабе К., Такасава Т., Каванами М., Като Х. (1989). Очистка и свойства 75-килодальтонного основного белка, иммунодоминантного поверхностного антигена, из орального анаэроба Bacteroides gingivalis. Заражение. Иммун. 57 год 3646–3652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зенобия К., Хаджишенгаллис Г. (2015). Porphyromonas gingivalis Факторы вирулентности, участвующие в разрушении лейкоцитов и микробном дисбактериозе. Вирулентность 6 236–243. 10.1080 / 21505594.2014.999567 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Zhang T., Hashizume T., Kurita-Ochiai T., Yamamoto M. (2009). Сублингвальная вакцинация белком внешней мембраны Porphyromonas gingivalis и лигандом Flt3 вызывает защитный иммунитет в полости рта. Biochem. Биофиз. Res. Commun. 390 937–941. 10.1016 / j.bbrc.2009.10.081 [PubMed] [CrossRef] [Google Scholar]
- Чжан В., Джу Дж., Ригни Т., Триббл Г. Д. (2011). Фимбрии Porphyromonas gingivalis важны для начальной инвазии остеобластов, но не для ингибирования их дифференцировки и минерализации. J. Periodontol. 82 909–916. 10.1902 / jop.2010.100501 [PubMed] [CrossRef] [Google Scholar]
Взаимосвязь между пародонтозом и масляной кислотой, продуцируемой пародонтопатическими бактериями | Воспаление и регенерация
Петерсен П.Е., Огава Х. Глобальное бремя заболеваний пародонта: к интеграции с профилактикой и контролем хронических заболеваний. Периодонтол 2000. 2012; 60: 15–39.
Артикул PubMed Google Scholar
Gaurilcikaite E, Renton T, Grant AD. Парадокс безболезненного пародонта. Oral Dis. 2017; 23: 451–63.
Артикул PubMed CAS Google Scholar
Niesten D, van Mourik K, van der Sanden W. Влияние естественных зубов на качество жизни пожилых людей с ослабленными зубами. Качественное исследование. BMC Public Health. 2012; 12: 839.
Артикул PubMed PubMed Central Google Scholar
Ленг WD, Zeng XT, Kwong JS, Hua XP. Заболевания пародонта и риск ишемической болезни сердца: обновленный метаанализ проспективных когортных исследований. Int J Cardiol. 2015; 201: 469–72.
Артикул PubMed Google Scholar
Серра-э-Сильва Филхо В., Касарин Р.С., Николела Эль-младший, Пассос Х.М., Саллум А.В., Гонсалвес РБ. Сходство микробного разнообразия в пародонтальных карманах и атероматозных бляшках у пациентов с сердечно-сосудистыми заболеваниями. PLoS One. 2014; 9: e109761.
Артикул PubMed PubMed Central CAS Google Scholar
Сареми А., Нельсон Р.Г., Таллок-Рид М., Хэнсон Р.Л., Сиверс М.Л., Тейлор Г.В., Шлоссман М., Беннетт PH, Дженко Р., Ноулер В.С..Заболевания пародонта и смертность при диабете 2 типа. Уход за диабетом. 2005; 28: 27–32.
Артикул PubMed Google Scholar
Chou YY, Lai KL, Chen DY, Lin CH, Chen HH. Риск ревматоидного артрита, связанный с воздействием пародонтита: общенациональное популяционное когортное исследование. PLoS One. 2015; 10: e0139693.
Артикул PubMed PubMed Central CAS Google Scholar
Harding A, Gonder U, Робинсон SJ, Crean S, Singhrao SK. Изучение связи между болезнью Альцгеймера, здоровьем полости рта, микробной эндокринологией и питанием. Front Aging Neurosci. 2017; 9: 398.
Артикул PubMed PubMed Central Google Scholar
Teixeira FB, Saito MT, Matheus FC, Prediger RD, Yamada ES, Maia CSF, Lima RR. Пародонтит и болезнь Альцгеймера: возможная сопутствующая патология между хроническим воспалительным заболеванием полости рта и нейровоспалением.Front Aging Neurosci. 2017; 9: 327.
Артикул PubMed PubMed Central Google Scholar
Нишихара Т., Косеки Т. Микробная этиология пародонтита. Периодонтол 2000. 2004; 36: 14–26.
Артикул PubMed Google Scholar
Niederman R, Buyle-Bodin Y, Lu BY, Robinson P, Naleway C. Концентрация короткоцепочечных карбоновых кислот в десневой жидкости десен человека.J Dent Res. 1997. 76: 575–9.
Артикул PubMed CAS Google Scholar
Фурусава Ю., Обата Ю., Фукуда С., Эндо Т.А., Накато Дж., Такахаши Д., Наканиши И., Уэтаке С., Като К., Като Т. и др. Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа. 2013; 504: 446–50.
Артикул PubMed CAS Google Scholar
Chang MC, Tsai YL, Chen YW, Chan CP, Huang CF, Lan WC, Lin CC, Lan WH, Jeng JH. Бутират индуцирует продукцию активных форм кислорода и влияет на развитие клеточного цикла в фибробластах десен человека. J Periodontal Res. 2013; 48: 66–73.
Артикул PubMed CAS Google Scholar
Cueno ME, Ochiai K. Повторное открытие пародонтальной масляной кислоты: новые взгляды на старый метаболит. Microb Pathog. 2016; 94: 48–53.
Артикул PubMed CAS Google Scholar
Jeng JH, Chan CP, Ho YS, Lan WH, Hsieh CC, Chang MC. Влияние бутирата и пропионата на адгезию, рост, кинетику клеточного цикла и синтез белка культивируемых фибробластов десен человека. J Periodontol. 1999; 70: 1435–42.
Артикул PubMed CAS Google Scholar
Курита-Очиай Т., Сето С., Сузуки Н., Ямамото М., Оцука К., Абэ К., Очиаи К. Масляная кислота вызывает апоптоз в воспаленных фибробластах. J Dent Res.2008; 87: 51–5.
Артикул PubMed CAS Google Scholar
Курита-Очиай Т., Фукусима К., Очиаи К. Индуцированный масляной кислотой апоптоз тимоцитов мышей, Т-клеток селезенки и Т-клеток Jurkat человека. Infect Immun. 1997; 65: 35–41.
PubMed PubMed Central CAS Google Scholar
Курита-Очиай Т., Очиаи К., Фукусима К. Летучие жирные кислоты, побочный продукт метаболизма пародонтопатических бактерий, индуцируют апоптоз в клетках лимфомы WEHI 231 и RAJI B и В-клетках селезенки.Infect Immun. 1998. 66: 2587–94.
PubMed PubMed Central CAS Google Scholar
Курита-Очиаи Т., Очиаи К., Фукусима К. Индуцированный масляной кислотой апоптоз Т-клеток опосредуется активацией каспаз-8 и -9 Fas-независимым образом. Clin Diagn Lab Immunol. 2001; 8: 325–32.
PubMed PubMed Central CAS Google Scholar
Yu X, Shahir AM, Sha J, Feng Z, Eapen B, Nithianantham S, Das B, Karn J, Weinberg A, Bissada NF, Ye F.Короткоцепочечные жирные кислоты пародонтальных патогенов подавляют гистоновые деацетилазы, EZh3 и SUV39h2, способствуя репликации герпесвируса Капоши, ассоциированного с саркомой. J Virol. 2014; 88: 4466–79.
Артикул PubMed PubMed Central CAS Google Scholar
Cueno ME, Ochiai K. Уровень пародонтоза (PD) десен — масляная кислота влияет на системную кровь и орган мозга: понимание системного воспаления пародонта.Фронт Иммунол. 2018; 9: 1158.
Артикул PubMed PubMed Central Google Scholar
Канг В., Ху З., Ге С. Здоровые и воспаленные фибробласты десны различаются по своей воспалительной реакции на липополисахарид Porphyromonas gingivalis. Воспаление. 2016; 39: 1842–52.
Артикул PubMed CAS Google Scholar
Ширасуги М., Нисиока К., Ямамото Т., Накая Т., Канамура Н.Нормальные фибробласты десен человека подвергаются цитостазу и апоптозу после длительного воздействия масляной кислоты. Biochem Biophys Res Commun. 2017; 482: 1122–8.
Артикул PubMed CAS Google Scholar
Чжан К., Чен Б., Чжу Д., Ян Ф. Уровни биомаркеров в десневой трещинной жидкости субъектов с различными состояниями пародонта: поперечное исследование. Arch Oral Biol. 2016; 72: 92–8.
Артикул PubMed CAS Google Scholar
Курита-Очиай Т., Очиаи К., Судзуки Н., Оцука К., Фукусима К. Фибробласты десен человека спасают индуцированный масляной кислотой апоптоз Т-клеток. Infect Immun. 2002; 70: 2361–7.
Артикул PubMed PubMed Central CAS Google Scholar
Имаи К., Очиаи К., Окамото Т. Реактивация латентной инфекции ВИЧ-1 пародонтопатической бактерией Porphyromonas gingivalis включает модификацию гистонов. J Immunol. 2009; 182: 3688–95.
Артикул PubMed CAS Google Scholar
Тейлор Дж. Дж. Цитокиновая регуляция иммунных ответов на Porphyromonas gingivalis. Периодонтол 2000. 2010; 54: 160–94.
Артикул PubMed Google Scholar
Porphyromonas gingivalis: основной пародонтопатический патоген Обзор
Porphyromonas gingivalis — это грамотрицательный оральный анаэроб, который участвует в патогенезе пародонтита и является представителем более 500 видов бактерий, обитающих в полости рта.Эта анаэробная бактерия является естественным членом микробиома полости рта, но может стать очень разрушительной (так называемый патобионт) и размножаться до большого количества клеток в поражениях пародонта: это связано с ее арсеналом специализированных факторов вирулентности. Цель этого обзора — дать обзор одного из основных патогенов пародонта — Porphyromonas gingivalis. Эта бактерия, наряду с Treponema denticola и Tannerella forsythia , составляет «красный комплекс», прототип полибактериального патогенного консорциума при пародонтите.В этом обзоре описывается структура Porphyromonas gingivalis , его метаболизм, его способность колонизировать эпителиальные клетки и его влияние на иммунитет хозяина.
1. Введение
Porphyromonas gingivalis — это грамотрицательный пероральный анаэроб, который участвует в патогенезе пародонтита, воспалительного заболевания, которое разрушает ткани, поддерживающие зуб, что в конечном итоге может привести к его потере. Среди более чем 500 видов бактерий, обитающих в полости рта, бактериальный комплекс, названный «красным комплексом», состоящий из Porphyromonas gingivalis , Treponema denticola и Tannerella forsythia , тесно связан с серьезными поражениями пародонта [1].
Исследования Porphyromonas gingivalis , пародонтопатогена, предоставили огромный объем информации с точки зрения филогенетических, а также протеомных критериев за последние 20 лет, которые могут превосходить других близкородственных членов, включая Bacteroides fragilis и Bacteroides. thetaiotaomicron , как основные анаэробные условно-патогенные микроорганизмы в стоматологической сфере. Микробиота слизистой оболочки ротовой полости человека состоит из множества видов бактерий, которые обычно существуют в комменсальной гармонии с хозяином. Porphyromonas gingivalis , этиологический агент при тяжелых формах пародонтита (хроническое воспалительное заболевание), является важным компонентом микробиома полости рта и успешным колонизатором эпителия полости рта [2].
Авторы использовали как последние, так и более старые обзоры и исследования, чтобы составить всесторонний обзор этого ключевого пародонтального патогена. Особое внимание было уделено клинически значимым свойствам Porphyromonas gingivalis , таким как патогенность и его возможное отношение к определенным системным заболеваниям.
2.
Porphyromonas gingivalis2.1. Свойства и патогенность
Porphyromonas gingivalisНарушение эпителиальных клеток бактериями является первым этапом инициации воспалительных и иммунных процессов, которые в конечном итоге вызывают разрушение тканей, окружающих и поддерживающих зубы, что в конечном итоге приводит к потере зубов [3] .
Porphyromonas gingivalis может локально поражать ткани пародонта и уклоняться от защитных механизмов хозяина.При этом он использует набор факторов вирулентности, которые вызывают нарушение регуляции врожденного иммунитета и воспалительных реакций [4].
Porphyromonas gingivalis быстро прикрепляется к поверхности клетки-хозяина с последующей интернализацией через липидные рафты и включением бактерии в ранние фагосомы. Porphyromonas gingivalis активирует клеточную аутофагию, обеспечивая репликативную нишу при подавлении апоптоза. Реплицирующаяся вакуоль содержит белки-хозяева, доставляемые посредством аутофагии, которые используются этим асахаролитическим патогеном для выживания и репликации в клетке-хозяине.Когда аутофагия подавляется 3-метиладенином или вортманнином, интернализованный Porphyromonas gingivalis переходит в фаголизосому, где он разрушается и деградирует. По этой причине выживание Porphyromonas gingivalis зависит от активации аутофагии и выживания эндотелиальной клетки-хозяина, но механизм, с помощью которого Porphyromonas gingivalis выполняет это, остается неясным [5].
Тяжелое воспалительное состояние пародонтального кармана предполагает, что этот организм обладает свойствами, которые облегчают его способность реагировать и адаптироваться к окислительному стрессу.Поскольку стрессовая реакция патогена является основным детерминантом его вирулентности, всестороннее понимание его стратегии устойчивости к окислительному стрессу является жизненно важным [6].
Способность Porphyromonas gingivalis вызывать пародонтит у взрослых определяется его арсеналом факторов вирулентности. Образование биопленок и активность бактериальной дипептидилпептидазы IV (DPPIV) вносят свой вклад в патогенный потенциал Porphyromonas gingivalis . Кроме того, образование биопленок может усиливать вирулентность Porphyromonas gingivalis за счет повышенной активности DPPIV.Из-за их важности для колонизации и роста бактерий образование биопленок и активность DPPIV могут представлять собой интересные терапевтические мишени для борьбы с пародонтитом [7].
Porphyromonas gingivalis сильно коррелирует с хроническим пародонтитом. Его хроническая стойкость в пародонте зависит от его способности уклоняться от иммунитета хозяина без подавления общей воспалительной реакции, что на самом деле полезно для этой и других пародонтальных бактерий. Действительно, воспалительный экссудат (жидкость десневой щели) является источником необходимых питательных веществ, таких как пептиды и железо, полученное из гемина [8].
Porphyromonas gingivalis вносит свой вклад в патогенез агрессивного пародонтита, индуцируя высокие уровни провоспалительных цитокинов, таких как IL-1 β и IL-6, периферическими CD4 + Т-хелперами [9]. Porphyromonas gingivalis серотипов K1 и K2, но не других, связаны с повышенным продуцированием фактора RANKL, связанного с остеокластогенезом. Эта важная информация предполагает, что эти серотипы могут вызывать большую резорбцию кости in vivo и играть важную роль в патогенезе пародонтита.Деструктивный периодонтит связан с Th2-Th27-иммунным ответом и активацией остеокластов, индуцированных RANKL. Кроме того, серотипы Porphyromonas gingivalis K1 и K2 вызывают сильный Th2-Th27-ответ. Эти серотипы Porphyromonas gingivalis вызывают более высокую активацию остеокластов за счет увеличения Th27-ассоциированной продукции RANKL и антиген-специфического ответа Т-лимфоцитов памяти [10]. Хроническая пероральная инфекция Porphyromonas gingivalis до индукции артрита увеличивает активацию иммунной системы, способствуя ответам клеток Th27, которые в конечном итоге ускоряют развитие артрита.Эти результаты предполагают, что хроническая инфекция полости рта может влиять на развитие ревматоидного артрита, главным образом, через активацию путей, связанных с Th27 [11].
Концентрации металлопротеиназы MMP-8, интерлейкина IL-1 β и Porphyromonas gingivalis в слюне связаны с различными клиническими и рентгенографическими показателями пародонтита. Индекс CRS, объединяющий три биомаркера слюны, связан с пародонтитом. Высокие концентрации в слюне металлопротеиназы MMP-8, интерлейкина IL-1 β и Porphyromonas gingivalis были связаны с углублением пародонтальных карманов и потерей альвеолярной кости, а MMP-8 и IL-1 β с кровотечением при зондировании [12 ].
Бактерия использует аминокислоты в качестве источников энергии и углерода и включает их в основном в виде дипептидов. Следовательно, широкий спектр процессов продукции дипептидов, опосредованных дипептидилпептидазами (DPP), может быть полезным для организма [13].
2.2. Вирулентность и рост
Porphyromonas gingivalis : роль железаБыло показано, что железо, используемое этим патогеном в форме гема, играет важную роль в его росте и вирулентности. Porphyromonas gingivalis не продуцирует сидерофоры.Вместо этого он использует специфические рецепторы внешней мембраны, протеазы (особенно гингипаины) и липопротеины для получения железа / гема. Были описаны специфические белки, участвующие в захвате железа и гема [14].
Кроме того, протеолитическая активность гингипаина R и гингипаина К способствует процессингу / созреванию различных белков клеточной поверхности Porphyromonas gingivalis , таких как фимбрилин fimA (субъединица основных фимбрий), белок 75 кДа (субъединица minor fimbriae), гемагглютинины и рецепторный белок гемоглобина, которые важны для бактерии, чтобы колонизировать и размножаться в десневой щели и вторгаться в пародонт.Эти данные убедительно указывают на критическую роль гингипаина R и гингипаина K в вирулентности Porphyromonas gingivalis [15]. Протеаза гингипаин R существует в виде белков 110, 95, 70-90 и 50 кДа, первые два представляют собой комплекс каталитической субъединицы 50 кДа с гемагглютинином / адгезинами, с добавленным пептидом, закрепляющим мембрану, или без него. Остальные формы представляют собой одноцепочечные ферменты. Преобладающая форма гингипаина К в штаммах Porphyromonas gingivalis представляет собой комплекс каталитического белка массой 60 кДа с гемагглютинином / адгезинами.Молекулярное клонирование и структурная характеристика генов гингипаина R и гингипаина K показали, что они кодируют 1704 и 1722 аминокислотных остатка препроферментов соответственно [16]. Вирулентность аргингипаина была дополнительно подтверждена разрушением генов, кодирующих аргингипаин, на хромосоме с использованием систем плазмид-самоубийц. С другой стороны, изучалась роль протеиназ, происходящих из клеток-хозяев, в разрушении тканей пародонта [17]. Уровни лизосомных протеиназ, таких как катепсины B, H, L и G, а также медуллазин, определяли в десневой десневой жидкости пациентов с пародонтитом и пациентов с экспериментальным гингивитом путем измерения активности и чувствительного иммуноанализа [17].
2.3. Вирулентность и рост
Porphyromonas gingivalis : роль адгезиновУдержанию и росту Porphyromonas gingivalis на различных поверхностях способствует набор адгезинов, включая фимбрии, гемагглютинины и протеиназы [18]. Гистатины — это пептиды слюнных желез человека, обладающие антимикробным и противовоспалительным действием. Мы предположили, что гистатин 5 связывается с Porphyromonas gingivalis гемагглютинином B (HagB) и ослабляет HagB-индуцированные хемокиновые ответы в миелоидных дендритных клетках человека.Таким образом, гистатин 5 способен ослаблять хемокиновые реакции, что может помочь контролировать воспаление полости рта [19].
Porphyromonas gingivalis продуцирует большие количества аргинин- и лизин-специфичных цистеиновых протеиназ в клеточно-ассоциированных и секреторных формах [20].
Эти ферменты, называемые гингипаинами, расщепляют белковые и пептидные субстраты после остатков аргинина (гингипаин R) и лизина (гингипаин K), и было обнаружено [21], что ни один из них не легко ингибируется ингибиторами протеиназы хозяина.Изучение свойств каждой протеиназы ясно указывает на роль (и) обеих в нарушении регуляции ряда обычно строго контролируемых путей. Последствиями такого неконтролируемого протеолиза являются развитие отека (активация калликреин / кининового пути гингипаином R), инфильтрация нейтрофилов (активация пути комплемента гингипаином R) и кровотечение (деградация фибриногена гингипаином K) [21]. Кристаллическая структура домена K1, адгезинового модуля лизин-гингипаина (Kgp), экспрессируемого на поверхности клетки пародонтопатической анаэробной бактерией Porphyromonas gingivalis W83, сопоставима с ранее определенными структурами гомологов K2 и K3, все три являются представителями семейства расщепленных доменов адгезина.В структуре K1 неожиданно нарушается конформация наиболее протяженной поверхностной петли, возможно, из-за упаковки кристаллов, и она смещается от ранее описанного положения заякорения аргинина, наблюдаемого в K2 и K3. Это смещение позволяет петле стать свободной для взаимодействия с другими белками; Конформация альтернативной перевернутой петли представляет собой новый механизм взаимодействия с белками-мишенями-хозяевами, другими бактериями или другими доменами белка гингипаина. Кроме того, модуль адгезина K1, как и другие, обнаруживается гемолитическим in vitro и, таким образом, участвует в распознавании эритроцитов, внося вклад в гемолитическую функцию Kgp.Также было обнаружено, что K1 избирательно связывается с гемальбумином с высоким сродством, предполагая, что этот домен может участвовать в опосредованном гингипаином приобретении гемальбумина из гемальбумина. Следовательно, наиболее вероятно, что все расщепленные домены адгезина Kgp вносят вклад в патогенность Porphyromonas gingivalis более сложным образом, чем просто опосредуют прикрепление бактерий [22].
Наличие антител к Porphyromonas gingivalis -специфическому фактору вирулентности аргинин гингипаин В проверяли методом ELISA.Значительно более высокие уровни анти-RgpB антител были обнаружены в подгруппе пародонтита по сравнению с подгруппой контроля непериодонтита. Значительно повышенные уровни анти-RgpB антител в сыворотке от пародонтита по сравнению с непериодонтитной сывороткой могут указывать на то, что повышенные уровни анти-RgpB IgG могут использоваться в качестве заместителя для хронического пародонтита в исследованиях, где состояние пародонта представляет интерес, но неизвестно [23].
Porphyromonas gingivalis Гемофороподобный белок HmuY связывает гем и удаляет гем из гемопротеинов хозяина для дальнейшей доставки его к родственному рецептору гема HmuR.Характеристика структурных особенностей вариантов HmuY в присутствии и в отсутствие гема в отношении роли остатков триптофана в конформационной стабильности является целью дальнейших исследований [24].
Porphyromonas gingivalis содержит чрезвычайно высокие концентрации цистеиновых протеиназ с трипсиноподобной активностью, которая считается фактором вирулентности при пародонтите у взрослых [21]. Некоторые из этих ферментов, по-видимому, экспрессируются как активные протеолитические продукты после обработки более крупных белков-предшественников.Кроме того, более свежие данные [25] предполагают тесную взаимосвязь между некоторыми из этих ферментов и двумя другими потенциальными факторами вирулентности Porphyromonas gingivalis : гемагглютининами и коллагеназами [25].
Компоненты поверхности Porphyromonas gingivalis контактируют с тканями и клетками хозяина из-за внешних клеточных элементов. В результате такие компоненты Porphyromonas gingivalis потенциально важны в возникновении заболеваний пародонта [26]. Porphyromonas gingivalis фимбрии являются критическим фактором для опосредования взаимодействия этого бактериального организма с тканями хозяина, поскольку Porphyromonas gingivalis способствует как бактериальной адгезии, так и вторжению в целевые участки. Porphyromonas gingivalis фимбрии, вероятно, прерывают клеточную передачу сигналов через белки / интегрины внеклеточного матрикса в областях пародонта. Фимбрии также считаются критически важными в инвазионных событиях этого бактериального организма к клеткам-хозяевам [27].
Фимбрии Porphyromonas gingivalis способны связываться с ферментами слюны, белками внеклеточного матрикса и комменсальными бактериями, а также прочно прикрепляться к клеточному альфа5бета1-интегрину [28]. После адгезии к альфа5бета1-интегрину Porphyromonas gingivalis захватывается клеточными псевдоподиями, которые обеспечивают инвагинацию через актин-опосредованный путь. Сообщалось, что инвазивное событие требует клеточного динамина хозяина, актиновых волокон, микротрубочек и липидных рафтов [28].После прохождения через эпителиальный барьер внутриклеточный патоген Porphyromonas gingivalis нарушает клеточную функцию. Porphyromonas gingivalis Фимбрии классифицируются на 6 генотипов (типы с I по V и Ib) на основании разнообразия генов fimA, кодирующих каждую субъединицу фимбрии. Внутриклеточный Porphyromonas gingivalis с фимбриями типа II явно разрушает связанные с интегрином сигнальные молекулы, паксиллин и киназу фокальной адгезии, которая блокирует клеточную миграцию и пролиферацию клеток-хозяев [28].У большинства пациентов с пародонтитом были обнаружены фибрии fimA типа II Porphyromonas gingivalis , за которыми следовали фибрии типа IV; Фимбрии fimA типа II Porphyromonas gingivalis достоверно чаще обнаруживались у пациентов с более тяжелыми формами пародонтита [29]. Porphyromonas gingivalis фимбрии действуют как важный фактор вирулентности в прогрессировании атеросклероза. Регуляторные Т-клетки (Treg) могут играть решающую роль в аутоиммунном ответе во время этого процесса.Однако остается неизвестным, связана ли инфекция Porphyromonas gingivalis с нарушением регуляции Treg во время атеросклероза, а распространенность различных генотипов Porphyromonas gingivalis FimA во время этого процесса неясна. Инфекция Porphyromonas gingivalis снижает уровень Treg у пациентов с атеросклерозом [30].
2.4. Липополисахарид
Porphyromonas gingivalisЛипополисахарид Porphyromonas gingivalis является ключевым фактором развития пародонтита.Фибробласты десен, которые являются основными составляющими соединительной ткани десен, могут напрямую взаимодействовать с Porphyromonas gingivalis и его бактериальными продуктами, включая липополисахариды, при поражениях пародонтита [31]. Из-за его способности сильно активировать воспалительные и врожденные защитные реакции хозяина, было предложено функционировать как важная молекула, которая предупреждает хозяина о потенциальной бактериальной инфекции. Однако, несмотря на высокую консервативность, липополисахарид содержит важные структурные различия между разными видами бактерий, которые могут значительно изменять ответы хозяина [32].Экспрессия мРНК связывающего белка ингибитора активатора плазминогена типа 1 (PAI-1) была увеличена в деснах пациентов с пародонтитом [33].
Липополисахарид Porphyromonas gingivalis увеличивает экспрессию EphB4, подавляя экспрессию EphrinB2 [34]. Porphyromonas gingivalis LPS индуцирует провоспалительные цитокины, такие как IL-1 β , IL-6 и IL-8, которые вызывают разрушение тканей пародонта. Стволовые клетки пародонтальной связки (PDLSC) играют важную роль в регенерации тканей пародонта и, как ожидается, в будущем найдут применение в клеточной терапии пародонтита. Porphyromonas gingivalis LPS подавлял активность щелочной фосфатазы, альфа-1 коллагена 1 типа, выработку и минерализацию остеокальцина в PDLSC, которые положительны для STRO-1 и SSEA-4. Porphyromonas gingivalis LPS также способствовал пролиферации клеток и продуцировал IL-1 β , IL-6 и IL-8 [35].
Эффект ЛПС Porphyromonas gingivalis сравнивали с действием синтетического триацилированного липопротеина Pam3-Cys-Ser- (Lys) 4 (Pam3CSK4), агониста Toll-подобного рецептора 2.Экспрессию гена и белка молекулы межклеточной адгезии-1, молекулы адгезии сосудистых клеток-1 и Е-селектина можно было измерить с помощью ОТ-ПЦР и проточной цитометрии, соответственно. Porphyromonas gingivalis LPS стимулирует уровни экспрессии всех молекул адгезии дозозависимым образом [36].
2,5. Цистеиновые протеазы
Porphyromonas gingivalisЦистеиновые протеазы Porphyromonas gingivalis являются внеклеточными продуктами важного этиологического агента при заболеваниях пародонта.Многие из действий этих ферментов in vitro согласуются с наблюдаемыми воспалительными и иммунными особенностями заболевания с нарушенной регуляцией [37]. Они являются важными мишенями иммунных ответов пораженных людей и рассматриваются некоторыми как потенциальные молекулярные мишени для терапевтических подходов к заболеваниям пародонта [37]. Эти ферменты участвуют как в разрушении тканей пародонта, так и в прерывании защитных механизмов хозяина за счет деградации иммуноглобулинов и факторов комплемента, что в конечном итоге приводит к прогрессированию заболевания [38].Использование моноспецифических мутантов, дефектных по отдельным протеазам, продемонстрировало важность протеазной активности для вирулентности, но также позволило предположить сложность функций ферментов в физиологии этих микроорганизмов [39].
2.6.
Porphyromonas gingivalis и система комплементаСистема комплемента является важным ответом хозяина на вторжение бактерий. Активация комплемента приводит к отложению C3b на бактериальной поверхности и фагоцитозу опсонизированных бактерий клетками-хозяевами.Альтернативно, весь путь комплемента, включая концевые компоненты C5b-9, может быть активирован на поверхности клетки, что приводит к генерации и встраиванию атакующего комплекса мембраны в бактериальную мембрану и лизису клеток. Устойчивость бактерий к комплементу может быть результатом ферментативного переваривания компонентов комплемента или генерации или получения от хозяина молекул клеточной поверхности, которые позволяют организму усваивать белки, контролирующие комплемент хозяина [40]. Проадгезивный путь инициируется, когда Porphyromonas gingivalis fimbriae связывают CD14 и активируют Toll-подобный рецептор 2 (TLR2) и передачу сигналов, опосредованную фосфатидилинозитол-3-киназой, что приводит к индукции высокоаффинной конформации CR3 в лейкоцитах.Хотя этот проадгезивный сигнальный путь TLR2 может обычно участвовать в усилении взаимодействий лейкоцитов с эндотелиальными клетками и трансэндотелиальной миграции, интригующие данные [41] позволяют предположить, что Porphyromonas gingivalis кооптировал этот путь для усиления взаимодействия фимбрий на клеточной поверхности с CR3. Действительно, активированный CR3 взаимодействует с фимбриями Porphyromonas gingivalis и и вызывает подавление активности р70 интерлейкина-12, ключевого цитокина, участвующего во внутриклеточном бактериальном клиренсе.Более того, взаимодействие активированного CR3 с Porphyromonas gingivalis приводит к интернализации патогена макрофагами. Поскольку CR3 с трудом активирует микробицидные механизмы и представляет собой «предпочтительный рецептор» для определенных внутриклеточных патогенов, возможное использование CR3 Porphyromonas gingivalis для уклонения от клиренса врожденного иммунитета может быть правдоподобной гипотезой [41].
Перекрестные помехи при передаче сигналов между комплементом и Toll-подобными рецепторами (TLR) обычно служат для координации иммунитета хозяина.Однако пародонтальная бактерия Porphyromonas gingivalis проявляет ферментативную активность, подобную С5-конвертазе, и умело использует перекрестные помехи комплемента-TLR, чтобы подорвать защиту хозяина и избежать элиминации. Интересно, что такое нарушение иммунного надзора приводит к ремоделированию микробиоты пародонта до дисбиотического состояния, которое вызывает воспалительный пародонтит. Понимание механизмов, с помощью которых Porphyromonas gingivalis модулирует функцию комплемента, вызывая дисбактериоз, предлагает новые цели для терапии комплемента [42].
2.7.
Porphyromonas gingivalis и NeutrofilsПародонтопатогены, такие как Porphyromonas gingivalis , разработали различные стратегии нарушения структурной и функциональной целостности эпителия десен. Porphyromonas gingivalis прикрепляется к эпителиальным клеткам человека, вторгается и реплицируется в них [43]. Пародонтит представляет собой важную модель поражения тканей хозяина, опосредованного нейтрофилами. Нейтрофилы, примированные или стимулированные наличием или постоянством инфекции, проявляют повышенный и чрезмерный ответ.Это, в свою очередь, приводит к разрушению тканей, опосредованному активностью нейтрофилов [44].
Запускающий рецептор, экспрессируемый на миелоидных клетках 1 (TREM-1), представляет собой рецептор клеточной поверхности суперсемейства иммуноглобулинов, обладающий способностью усиливать продукцию провоспалительных цитокинов и регулировать апоптоз. Полиморфноядерные нейтрофилы (PMN) являются первой линией защиты от инфекции и основным источником TREM-1. Дифференциальная регуляция TREM-1 гингипаинами Porphyromonas gingivalis может представлять новый механизм, с помощью которого Porphyromonas gingivalis манипулирует врожденным иммунным ответом хозяина, помогая вызвать хроническое воспаление пародонта [45].
2,8.
Porphyromonas gingivalis и пути передачи сигналаPorphyromonas gingivalis могут модулировать пути передачи сигнала эукариотическими клетками, направляя его захват эпителиальными клетками десен. Внутри этого привилегированного сайта Porphyromonas gingivalis может реплицироваться и воздействовать на компоненты врожденной защиты хозяина [46]. Выяснение возможной ассоциации генотипических профилей при заболевании или клинически здоровом состоянии важно для понимания патогенных характеристик Porphyromonas gingivalis .Генотипическая характеристика штаммов Porphyromonas gingivalis выявила значительную гетерогенность природных популяций этой бактерии [47]. Регуляция гемин-чувствительных генов в Porphyromonas gingivalis может происходить с помощью негативного регулятора, как было описано для других патогенных организмов [48].
Внеклеточная передача сигналов во время воспаления и хронических заболеваний включает молекулы, называемые «сигналами опасности», включая низкомолекулярный аденозин.Первичные эпителиальные клетки десны экспрессируют семейство рецепторов, связанных с G-белком, известных как аденозиновые рецепторы, включая высокоаффинные рецепторы A1 и A2a и низкоаффинные рецепторы A2b и A3. Антагонизм и нокдаун рецептора A2a посредством РНК-интерференции значительно снижает метаболически активную внутриклеточную активность Porphyromonas gingivalis . Эпителиальные клетки десны экспрессируют функциональный рецептор A2a, а Porphyromonas gingivalis может использовать аденозиновый сигнал «Danger Signals», связанный с рецептором A2a, в качестве средства для успешного сохранения устойчивости в слизистой оболочке полости рта, возможно, посредством подавления провоспалительной реакции [49].
2.9. Недавние исследования
Porphyromonas gingivalisВ настоящее время исследователи пытаются выяснить, как именно работает симбиоз между популяциями бактерий во рту, особенно между Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans , поскольку они являются основными причинами гингивита. Их конкретные цели включают наблюдение, какие компоненты перемещаются между бактериями, поскольку уже было доказано, что ни один вид бактерий не может выжить без другого [50].Кроме того, все больше исследований сосредоточено на фимбриях, в частности, на поиске способов подавления образования незначительных фимбрий, поскольку это могло бы предотвратить образование биопленки на зубе [51]. Еще одна важная область исследований — выяснить, как работают современные методы уничтожения этих патогенов, такие как нитрат аммония. Несмотря на то, что подобные растворы используются уже некоторое время, точный механизм их цитотоксичности неизвестен [52].
Дальнейшие исследования, направленные на поиск причин, которые вызывают изменения в оральном гомеостазе, что способствует росту Aggregatibacter actinomycetemcomitans , могут дать представление о новых стратегиях профилактики пародонтита, ассоциированного с Aggregatibacter actinomycetemcomitans .Поскольку инфекция Porphyromonas gingivalis связана с типичной экопатологией пародонта, восприимчивость к передаче от человека к человеку возбудителя Porphyromonas gingivalis можно контролировать с помощью пародонтального лечения и подчеркивая важность соблюдения высоких стандартов гигиены полости рта [53].
Недавние клинические и эпидемиологические исследования предоставили убедительные доказательства значительной связи между ревматоидным артритом и пародонтитом. Более того, наши результаты показывают, что Porphyromonas gingivalis , главный этиологический фактор пародонтита, способствует развитию и прогрессированию артрита, индуцированного коллагеном [54].
Porphyromonas gingivalis , основная причина хронического пародонтита, также вовлечена в этиологию ревматоидного артрита, особенно в отношении антител к цитруллинированному белку / пептиду, на основании его уникального свойства среди патогенных микроорганизмов экспрессировать цитруллинирующую пептидиларгининдезе. [23]. Porphyromonas gingivalis пептидиларгининдеиминаза обладает способностью превращать остатки аргинина в белках в цитруллин. Цитруллинирование белка изменяет структуру и функцию белка; следовательно, пептидил-аргининдезиминаза может участвовать в нарушении регуляции сигнальной сети хозяина и уклонении от иммунитета.Более того, накопленные данные свидетельствуют о роли аутоиммунитета против цитруллинированных белков в развитии ревматоидного артрита [55].
Исследование влияния катехин-эпигаллокатехин-галлата чая на сформировавшиеся биопленки и образование биопленок с помощью Porphyromonas gingivalis , основного патогена пародонтоза, показало, что катехин-эпигаллокатехин-галлат разрушает образование установленных биопленок и биофилозов . .
Результаты текущих исследований показывают, что при лечении LPS из Porphyromonas gingivalis рецептор EphB4 на остеобластах и лиганд EphrinB2 на остеокластах могут генерировать двунаправленные антиостеокластогенные и про-остеобластогенные сигналы, которые могут способствовать передаче сигналов костной ткани в соответствующие клетки. резорбция до образования кости. В ремоделировании кости семейство Eph участвует в регуляции процесса координации остеокластов и остеобластов, чтобы поддерживать гомеостаз кости [57].
Лептоменингеальные клетки передают воспалительные сигналы от периферических макрофагов к резидентной в головном мозге микроглии в ответ на липополисахарид Porphyromonas gingivalis . Экспрессия Toll-подобного рецептора 2 (TLR2), TLR4, TNF- α и индуцибельной NO-синтазы в основном обнаруживалась в макрофагах десен пациентов с хроническим пародонтитом. Лептоменинги служат важным путем передачи воспалительных сигналов от макрофагов к микроглии путем секреции провоспалительных медиаторов во время хронического периодонтита [58].
3. Заключение
Porphyromonas gingivalis является основным возбудителем тяжелого пародонтита у взрослых. Резорбция альвеолярной кости — один из важнейших факторов конструкции протезов. Porphyromonas gingivalis вызывает резорбцию альвеолярной кости, и морфологические измерения являются наиболее частыми методами определения резорбции кости при исследованиях пародонта [57]. Микробиота слизистой оболочки ротовой полости человека состоит из множества видов бактерий, которые обычно существуют в комменсальной гармонии с хозяином. Porphyromonas gingivalis, , этиологический агент при тяжелых формах пародонтита (хроническое воспалительное заболевание), является важным компонентом микробиома полости рта и успешным колонизатором эпителия полости рта [59].
Липополисахарид Porphyromonas gingivalis системно циркулирует более чем у 50% пациентов с заболеваниями пародонта и связан с повышенным содержанием матриксной металлопротеиназы. Низкосистемный липополисахарид стимулирует воспалительную реакцию в левом желудочке через металлопротеиназу, что приводит к снижению сердечной функции [60].На внешней мембране везикулы Porphyromonas gingivalis содержат факторы вирулентности, такие как липополисахарид и гингипаины. Сыворотки пациентов с пародонтитом имели значительно более высокую реактивность против штамма, продуцирующего везикулы наружной мембраны, чем штамм, истощенный изогенными везикулами наружной мембраны. Везикулы внешней мембраны, содержащие гингипаин, могут способствовать разрушению тканей при заболеваниях пародонта, выступая в качестве переносчика антигенов и активных протеаз [61]. Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans могут передаваться от члена семьи к члену семьи и могут вызывать пародонтит у реципиента [40].
Недавние успехи в понимании патомеханизмов Porphyromonas gingivalis могут привести к разработке новых стратегий ликвидации Porphyromonas gingivalis и лечения заболеваний пародонта в будущем.
Биомедицинские исследования последних десятилетий дали огромные доказательства вклада микробиома в развитие множества хронических заболеваний человека.Появляются доказательства того, что Porphyromonas gingivalis , хорошо адаптированный условно-патогенный микроорганизм слизистой оболочки полости рта и важный компонент биопленок полости рта, наиболее известный своим участием в периодонтите, может быть важным медиатором в развитии ряда многофакторных и, казалось бы, не связанные хронические заболевания, такие как ревматоидный артрит и рак органов пищеварения. Рак органов пищеварения составляет значительную долю от общего числа злокачественных новообразований во всем мире и включает рак полости рта, желудочно-кишечного тракта и поджелудочной железы.Для предотвращения и / или улучшения прогноза этих заболеваний очень необходимо хорошее понимание патофизиологических механизмов и взаимодействия между Porphyromonas gingivalis и хозяином [62].
Porphyromonas gingivalis , этиологический агент при тяжелых формах пародонтита, является важным компонентом микробиома полости рта и успешным колонизатором эпителия полости рта. Этот грамотрицательный анаэроб может также существовать в эпителии хозяина без наличия явного заболевания. Porphyromonas gingivalis , по-видимому, является высокоадаптированным патогеном микробиома полости рта. Последние исследования, как правило, сосредоточены на изучении его возможного прямого и косвенного влияния на определенные системные заболевания, такие как атеросклероз и ревматоидный артрит. Взаимоотношения между Porphyromonas gingivalis и другими возбудителями ротовой полости являются еще одним предметом интенсивных исследований.
Авторы использовали как последние, так и более старые обзоры и исследования, чтобы составить всесторонний обзор этого ключевого пародонтального патогена.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Исследование было поддержано исследовательским проектом PRVOUK-P28 / LF1 / 6 Министерства образования, молодежи и спорта Чешской Республики и проектами NT 13087-3 и NT 14164-3 Агентства внутренних грантов, Министерство здравоохранения Чешской Республики.
Предполагаемые пародонтопатические бактерии и герпесвирусы у беременных: исследование случай-контроль
Penova-Veselinovic, B., Килан, Дж. А., Ван, К. А., Ньюнхэм, Дж. П. и Пеннелл, С. Е. Изменения медиаторов воспаления в десневой трещинной жидкости после лечения пародонтоза во время беременности: связь с неблагоприятным исходом беременности. Журнал репродуктивной иммунологии 112 , 1–10, DOI: 10.1016 / j.jri.2015.05.002 (2015).
CAS Статья PubMed Google Scholar
Chambrone, L., Guglielmetti, M. R., Pannuti, C. M. и Chambrone, L. A. Уровень доказательств, связывающий пародонтит с преждевременными родами и / или низкой массой тела при рождении: I. Систематический обзор проспективных когортных исследований. Журнал клинической пародонтологии . 795–808, DOI: 10.1111 / j.1600-051X.2011.01755.x (2011).
Пильстром, Б. Л., Михалович, Б. С. и Джонсон, Н. В. Заболевания пародонта. Lancet 366 , 1809–1820, DOI: 10.1016 / S0140-6736 (05) 67728-8 (2005).
Артикул Google Scholar
Thomasini, R.Л., Бонон, С. Х., Дуранте, П. и Коста, С. С. Корреляция цитомегаловируса и вируса герпеса человека 7 с клетками CD3 + и CD3 + CD4 + у пациентов с хроническим пародонтитом. Журнал пародонтологических исследований 47 , 114–120, DOI: 10.1111 / j.1600-0765.2011.01413.x (2012).
CAS Статья PubMed Google Scholar
Riep, B. et al. Являются ли предполагаемые патогены пародонта надежными диагностическими маркерами? Журнал клинической микробиологии 47 , 1705–1711, DOI: 10.1128 / JCM.01387-08 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Abusleme, L. et al. Поддесневой микробиом в здоровье и пародонтите и его связь с биомассой сообщества и воспалением. Журнал ISME 7 , 1016–1025, DOI: 10.1038 / ismej.2012.174 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Слоты, J.Герпесвирусный пародонтит: инфекция вне биопленки. Журнал Калифорнийской стоматологической ассоциации 39 , 393–399 (2011).
PubMed Google Scholar
Slots, J. Вирусы человека при пародонтите. Пародонтология 2000 53 , 89–110, DOI: 10.1111 / j.1600-0757.2009.00325.x (2010).
Артикул PubMed Google Scholar
Слоты, J.Герпесвирусно-бактериальные взаимодействия при заболеваниях пародонта. Пародонтология 2000 52 , 117–140, DOI: 10.1111 / j.1600-0757.2009.00308.x (2010).
Артикул PubMed Google Scholar
Страка М. и Трапезанлидис М. Пародонтит и инсульт. Письма по нейроэндокринологии 34 , 200–206 (2013).
PubMed Google Scholar
Шарма Р.и другие. Сравнительный анализ наличия цитомегаловируса (CMV) и вируса Эпштейнбарр -1 (EBV-1) в случаях хронического пародонтита и агрессивного пародонтита с контрольной группой. Индийский журнал стоматологических исследований: официальная публикация Индийского общества стоматологических исследований 23 , 454–458, DOI: 10.4103 / 0970-9290.104948 (2012).
Артикул Google Scholar
Като, А., Имаи, К., Очиай, К. и Огата, Ю.Более высокая распространенность ДНК вируса Эпштейна-Барра в более глубоких пародонтальных карманах хронического пародонтита у японских пациентов. PloS one 8 , e71990, DOI: 10.1371 / journal.pone.0071990 (2013).
CAS ОБЪЯВЛЕНИЯ Статья PubMed PubMed Central Google Scholar
Сайгун И. и др. Обнаружение вирусов человека у пациентов с хроническим пародонтитом и взаимосвязь между вирусами и клиническими параметрами. Пародонтологический журнал 73 , 1437–1443, DOI: 10.1902 / jop.2002.73.12.1437 (2002).
Артикул PubMed Google Scholar
Zhu, C. et al. Связь между герпесвирусами и хроническим пародонтитом: метаанализ, основанный на исследованиях случай-контроль. PloS one 10 , e0144319, DOI: 10.1371 / journal.pone.0144319 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Ашимото, А., Chen, C., Bakker, I. & Slots, J. Обнаружение 8 предполагаемых патогенов пародонта в поддесневой бляшке при гингивите и поздних поражениях пародонтита. Микробиология и иммунология полости рта 11 , 266–273 (1996).
CAS Статья Google Scholar
Tellapragada, C. et al. Распространенность клинического пародонтита и предполагаемых патогенов пародонта среди беременных женщин Южной Индии. Международный журнал микробиологии 2014 , 420149, DOI: 10.1155 / 2014/420149 (2014).
Артикул PubMed PubMed Central Google Scholar
Имбронито, А. В., Окуда, О. С., Мария де Фрейтас, Н., Морейра Лотуфо, Р. Ф. и Нунес, Ф. Д. Обнаружение герпесвирусов и патогенов пародонта в поддесневой бляшке у пациентов с хроническим пародонтитом, генерализованным агрессивным пародонтитом или гингивитом. Пародонтологический журнал 79 , 2313–2321, DOI: 10.1902 / jop.2008.070388 (2008).
CAS Статья PubMed Google Scholar
Rotola, A. et al. Вирус герпеса человека 7, вирус Эпштейна-Барра и цитомегаловирус человека в тканях пародонта здоровых и больных пародонтом. Журнал клинической пародонтологии 35 , 831–837, DOI: 10.1111 / j.1600-051X.2008.01301.х (2008 г.).
CAS Статья PubMed Google Scholar
Эрес, Г., Алтиок, Э., Озкул, А. и Ацикель, К. Х. Поддесневой эпштейн-Барр и возникновение цитомегаловируса при гингивите беременных. Пародонтологический журнал 82 , 1676–1684, DOI: 10.1902 / jop.2011.100587 (2011).
CAS Статья PubMed Google Scholar
Wu, Y.M. et al. Корреляция между инфекциями с различными генотипами цитомегаловируса человека и вирусом Эпштейна-Барра в поддесневых образцах и пародонтальным статусом пациентов. Журнал клинической микробиологии 45 , 3665–3670, DOI: 10.1128 / JCM.00374-07 (2007).
CAS Статья PubMed PubMed Central Google Scholar
Cardoso, C. R. et al. Характеристика CD4 + CD25 + естественных регуляторных Т-клеток в воспалительном инфильтрате хронического пародонтита человека. Журнал биологии лейкоцитов 84 , 311–318, DOI: 10.1189 / jlb.0108014 (2008).
CAS Статья PubMed Google Scholar
Mendez, J. C. et al. Взаимодействие бета-герпесвируса человека у реципиентов трансплантата твердых органов. Журнал инфекционных болезней 183 , 179–184, DOI: 10.1086 / 317929 (2001).
CAS Статья PubMed Google Scholar
Фельдштейн, А.E. et al. Распространенность и клиническое значение активной инфекции герпеса 6 и 7 человека у детей, перенесших трансплантацию печени. Педиатрическая трансплантация 7 , 125–129 (2003).
Артикул Google Scholar
Michalowicz, B. S., Ronderos, M., Camara-Silva, R., Contreras, A. & Slots, J. Герпесвирусы человека и Porphyromonas gingivalis связаны с ювенильным пародонтитом. Пародонтологический журнал 71 , 981–988, DOI: 10.1902 / jop.2000.71.6.981 (2000).
CAS Статья PubMed Google Scholar
Teughels, W. et al. Цитомегаловирус человека усиливает прикрепление A. actinomycetemcomitans к клеткам. J Dent Res 86 , 175–180 (2007).
CAS Статья Google Scholar
Сайгун И., Кубар А., Оздемир А., Япар М. и Слотс Дж. Герпесвирусно-бактериальные взаимоотношения при агрессивном пародонтите. Журнал пародонтологических исследований 39 , 207–212, DOI: 10.1111 / j.1600-0765.2004.00728.x (2004).
Артикул PubMed Google Scholar
Слоты, Дж. И Контрерас, А. Герпесвирусы: объединяющий причинный фактор при пародонтите? Oral Microbiol Immunol 15 , 277–280 (2000).
CAS Статья Google Scholar
Имаи К.и другие. Пародонтальный патоген Porphyromonas gingivalis индуцирует трансактиватор литического переключения вируса Эпштейна-Барра ZEBRA путем модификации гистона. Biochimie 94 , 839–846, DOI: 10.1016 / j.biochi.2011.12.001 (2012).
CAS Статья PubMed Google Scholar
Редди, М. С. Достижение лучшего понимания не оральных заболеваний и последствий пародонтальных инфекций. Periodontol 2000 44 , 9–14, DOI: 10.1111 / j.1600-0757.2007.00213.x (2007).
Артикул PubMed Google Scholar
Слоты, J. Герпесвирусы при заболеваниях пародонта. Periodontol 2000 38 , 33–62, DOI: 10.1111 / j.1600-0757.2005.00109.x (2005).
Артикул PubMed Google Scholar
Сайгун И., Кубар А., Сахин С., Сенер К. и Слотс Дж. Количественный анализ связи между герпесвирусами и бактериальными патогенами при пародонтите. Журнал пародонтологических исследований 43 , 352–359, DOI: 10.1111 / j.1600-0765.2007.01043.x (2008).
CAS Статья PubMed Google Scholar
Ботеро, Дж. Э., Видаль, С., Контрерас, А. и Парра, Б. Сравнение вложенной полимеразной цепной реакции (ПЦР), ПЦР в реальном времени и вирусной культуры для обнаружения цитомегаловируса в поддесневых образцах. Oral Microbiol Immunol 23 , 239–244, DOI: 10.1111 / j.1399-302X.2007.00418.x (2008).
CAS Статья PubMed Google Scholar
Piiparinen, H., Hockerstedt, K., Gronhagen-Riska, C. & Lautenschlager, I. Сравнение двух количественных тестов ЦМВ ПЦР, анализа Cobas Amplicor CMV Monitor и TaqMan, а также анализа pp65-антигенемии при определении вирусных нагрузок периферической крови пациентов с трансплантацией органов. J Clin Virol 30 , 258–266, DOI: 10.1016 / j.jcv.2003.12.010 (2004).
CAS Статья PubMed Google Scholar
Contreras, A., Nowzari, H. & Slots, J. Герпесвирусы в образцах тканей пародонтального кармана и десны. Oral Microbiol Immunol 15 , 15–18 (2000).
CAS Статья Google Scholar
Кауфман, Э. и Ламстер, И. Б. Диагностические применения слюны — обзор. Crit Rev Oral Biol Med 13 , 197–212 (2002).
Артикул Google Scholar
Слотс, Дж. И Слотс, Х. Бактериальные и вирусные патогены в слюне: взаимосвязь заболеваний и инфекционный риск. Periodontol 2000 55 , 48–69, DOI: 10.1111 / j.1600-0757.2010.00361.x (2011).
Артикул PubMed Google Scholar
Сайгун, И.и другие. Инфекционные агенты слюны и статус заболеваний пародонта. Журнал пародонтологических исследований 46 , 235–239, DOI: 10.1111 / j.1600-0765.2010.01335.x (2011).
CAS Статья PubMed Google Scholar
Умеда, М., Контрерас, А., Чен, К., Баккер, И. и Слотс, Дж. Использование цельной слюны для обнаружения орального присутствия пародонтопатических бактерий. J Periodontol 69 , 828–833, DOI: 10.1902 / jop.1998.69.7.828 (1998).
CAS Статья PubMed Google Scholar
Sunde, P. T., Olsen, I., Enersen, M. & Grinde, B. Пациент с тяжелым пародонтитом и поддесневым вирусом Эпштейна-Барра, получавший противовирусную терапию. Журнал клинической вирусологии: официальное издание Панамериканского общества клинической вирусологии 42 , 176–178, DOI: 10.1016 / j.jcv.2008.01.007 (2008).
Артикул Google Scholar
Ито, А.и другие. Способность вводимого перорально IFN-альфа подавлять естественное воспаление десен у собак. Журнал ветеринарной медицины / Японское общество ветеринарных наук 72 , 1145–1151 (2010).
CAS Статья Google Scholar
Vogt, M., Sallum, A. W., Cecatti, J. G. & Morais, S. S. Факторы, связанные с распространенностью заболеваний пародонта у беременных из группы низкого риска. Репродуктивное здоровье 9 , 3, DOI: 10.1186 / 1742-4755-9-3 (2012).
Артикул PubMed PubMed Central Google Scholar
Баумгартнер, Дж. К., Сикейра, Дж. Ф., младший, Ся, Т. и Рокас, И. Н. Географические различия бактерий, обнаруживаемых при эндодонтических инфекциях с помощью полимеразной цепной реакции. Журнал эндодонтии 30 , 141–144, DOI: 10.1097 / 00004770-200403000-00004 (2004).
CAS Статья PubMed Google Scholar
Нишияма, С. А., Накано, В., Веласкес-Мелендес, Г. и Авила-Кампос, М. Дж. Возникновение вируса простого герпеса 1 и трех пародонтальных бактерий у пациентов с хроническим пародонтитом и некрозом пульпы. Канадский микробиологический журнал 54 , 326–330, DOI: 10.1139 / w08-006 (2008).
CAS Статья PubMed Google Scholar
Распространенность заболеваний пародонта и пародонтопатических бактерий у взрослых из группы риска без артрита, положительных по антителам к циклическому цитруллинированному белку | Гериатрия | Открытие сети JAMA
Ключевые моменты español 中文 (китайский)Вопрос Какова распространенность заболеваний пародонта и цитруллинирующих пародонтопатических бактерий у лиц из группы риска (CCP + в группе риска), положительных по антициклическому цитруллинированному белку, по сравнению со здоровой контрольной группой и пациентами с ранним ревматоидным артритом (РА)?
Выводы Это поперечное исследование выявило повышенную распространенность участков пародонтоза, клинического периодонтита и площади воспаленной поверхности пародонта у лиц из группы риска CCP + и лиц с ранним RA по сравнению с контрольной группой.Результаты показали, что у лиц из группы риска CCP + увеличилось количество Porphyromonas gingivalis на здоровых участках пародонта по сравнению с контрольной группой и пациентами с ранним RA.
Значение У лиц с риском РА, пародонтит и P gingivalis были увеличены до заболевания суставов и могут быть целью для профилактики.
Важность Распространенность пародонтита увеличивается у пациентов с ревматоидным артритом (РА), а пародонтопатические бактерии могут цитруллинировать белки.Следовательно, пародонтит может быть инициатором РА и мишенью для профилактики. Заболевания пародонта и пародонтальные бактерии не изучались у лиц из группы риска с аутоиммунитетом против РА, но без артрита.
Цель Изучить заболевания пародонта и пародонтопатические бактерии у лиц из группы риска без артрита, положительных по антителам к антициклическому цитруллинированному белку (anti-CCP).
Дизайн, обстановка и участники Это перекрестное исследование проводилось в клинической больнице с 27 апреля 2015 года по 8 мая 2017 года.На национальном уровне было набрано 48 человек с положительной реакцией на анти-CCP без артрита (CCP + в группе риска). Двадцать шесть пациентов с ранним РА (ERA) и 32 здоровых человека были набраны на месте. Данные были проанализированы в период с 1 июня 2017 г. по 1 декабря 2017 г.
Вмешательства Оценка пародонта и исследование суставов с помощью УЗИ.
Основные результаты и мероприятия Распространенность пораженных участков пародонта, клинического периодонтита и воспаленной поверхности пародонта у лиц из группы риска CCP + по сравнению с пациентами с ERA и здоровыми людьми, сопоставимыми по возрасту и курению.Было выполнено секвенирование парных концов ДНК поддесневой бляшки из пораженных и здоровых участков пародонта, а также профилирование и анализ ДНК.
Результаты Всего 48 лиц из группы риска CCP + (средний возраст [SD] 51,9 [11,4] лет; 31 [65%] женщина), 26 пациентов с ERA (средний возраст [SD] 54,4 [16,7] лет; 14 [54] %] женщин) и 32 здоровых человека (средний [SD] возраст 49,4 [15,3] года; 19 [59%] женщин). Из 48 пациентов группы риска CCP + у 46 не было воспаления суставов на УЗИ.Тридцать пять CCP + лиц из группы риска (73%), 12 здоровых людей (38%) и 14 пациентов с ERA (54%) имели клинический периодонтит. Медиана (межквартильный размах) процент пораженных участков пародонта была выше у лиц из группы риска CCP + по сравнению со здоровыми людьми (3,3% [0% -11,3%] против 0% [0% -0,7%]) и аналогична пациентам с ERA (1,1% [0% -13,1%]). Медиана (межквартильный размах) площади воспаленной поверхности пародонта была выше у лиц из группы риска CCP + по сравнению со здоровыми людьми (221 мм 2 [81-504 мм 2 ] против 40 мм 2 [12-205 мм 2 ] ]).Пациенты с CCP + в группе риска имели повышенное относительное количество Porphyromonas gingivalis (но не Aggregatibacter actinomycetemcomitans ) на здоровых участках пародонта по сравнению со здоровыми людьми (размер эффекта 3,00; 95% ДИ 1,71-4,29) и пациентами с ERA ( величина эффекта 2,14; 95% ДИ 0,77–3,52).
Выводы и значимость Это исследование показало повышенную распространенность пародонтита и P gingivalis у лиц из группы риска CCP +.Это говорит о том, что пародонтит и P gingivalis связаны с началом заболевания и могут быть мишенями для профилактических вмешательств при РА.
Аутоантитела, связанные с ревматоидным артритом (РА), могут быть обнаружены в сыворотке крови за годы до того, как у пациентов разовьется воспаление суставов, 1 -3 , что позволяет предположить, что суставы могут быть мишенью, а не основной причиной этого заболевания. Такие наблюдения предполагают доклиническую фазу РА и, что важно, повышают возможность профилактики заболевания.Обогащение сывороточных IgA антицитруллинированных белковых антител (ACPA) у лиц с риском развития RA предполагает, что участки слизистой оболочки (например, слизистая оболочка полости рта) могут быть важны в самой ранней фазе RA. 4 , 5 Имеются убедительные доказательства того, что пародонтит и РА клинически связаны. 6 -8 Кроме того, пародонтит связан со специфической бактериальной сигнатурой, характеризующейся повышенной численностью патогенного организма Porphyromonas gingivalis наряду с сообществом других, преимущественно анаэробных, организмов. 9 Porphyromonas gingivalis способен цитруллинировать местные антигены благодаря ферменту пептидиларгининдезиминаза. 10 В предполагаемой этиологической модели вирулентные штаммы P gingivalis на воспаленных участках пародонта генерируют новые цитруллинированные антигены, которые запускают иммунный ответ слизистой оболочки у некоторых людей, возможно, с генетической предрасположенностью. 11 Последние данные показывают, что пародонтопатическая бактерия Aggregatibacter actinomycetemcomitans может также непосредственно индуцировать цитруллинирование нейтрофилов в пародонте 12 и, следовательно, потенциально инициировать ACPA.
Несмотря на эти наблюдения, насколько нам известно, пародонтит и цитруллинирующие бактерии не описаны у лиц с риском развития РА. Мы стремились всесторонне измерить пародонтит и численность ключевых цитруллинирующих бактерий у лиц, которые были положительными по ACPA (т. Е. Людей, положительных по антициклическому цитруллинированному белку [CCP] без синовита и с риском развития RA), пациентов с положительными анти-CCP в раннем РА (ERA) и здоровые контрольные люди. Мы предположили, что (1) периодонтит будет одинаково увеличиваться у лиц из группы риска CCP + и у лиц с ERA по сравнению со здоровыми людьми и (2) будет повышенное количество цитруллинирующих пародонтопатических бактерий у лиц из группы риска CCP + и пациентов с ERA по сравнению с со здоровыми людьми.
Поперечное исследование пародонтальных и клинических параметров было выполнено у лиц из группы риска CCP +, пациентов с ERA и здоровых людей в период с 27 апреля 2015 г. по 8 мая 2017 г. группы, в соответствии с рекомендациями по пилотным исследованиям. Группы примерно совпадали по частоте во время набора по возрасту, полу и курению.После набора 20 CCP + людей из группы риска, 20 здоровых людей и 10 пациентов с ERA были проанализированы демографические данные и данные о курении. Приблизительное сопоставление частот было выполнено для набора оставшихся здоровых людей и пациентов с ERA в возрастном диапазоне от 31 до 70 лет и для набора сбалансированного числа в пределах тертилей возраста, рассчитанных для первых 20 CCP + индивидуумов из группы риска (первый и третий тертили 52 и 60 лет соответственно). Мы приблизительно сопоставили долю участников, которые когда-либо курили, которая составляла 60% в первых 20 группах риска CCP +.
Метагеномный анализ методом дробовика был проведен на образцах поддесневого налета, собранных во время пародонтальной оценки.
Этическое одобрение этого исследования было предоставлено Комитетом Национальной службы этики исследований Йоркшира и Хамбера, Лидс-Уэст. Письменное информированное согласие было получено от всех участников. Это исследование проводилось в соответствии с Руководством по отчетности по усилению отчетности наблюдательных исследований в эпидемиологии (STROBE). 13
В больницу Chapel Allerton, Лидс, Соединенное Королевство было набраноанти-CCP-позитивных лиц группы риска с симптомами опорно-двигательного аппарата, но без клинического синовита, пациентов с ERA и бессимптомных здоровых людей.
Мы набрали участников группы риска CCP + из группы риска Лидса. 14 , 15 К участию были приглашены пациенты старше 18 лет, обращающиеся к терапевтам или другим медицинским работникам с впервые появившимися скелетно-мышечными симптомами, но без клинического синовита. Набор сотрудников первичной медицинской помощи был принят на национальном уровне Сетью клинических исследований первичной медико-санитарной помощи Великобритании. Тестирование на анти-ЦЦП выполняли централизованно с использованием набора Bioplex 2200 (BioRad). Те, у кого был положительный результат теста, были приглашены в специализированную исследовательскую клинику в Лидсе, где проводился набор для этого исследования.Были также набраны пациенты из клиники раннего артрита в Лидсе, у которых были положительные анти-CCP, но не было клинического синовита. Все пациенты с ERA были анти-CCP-положительными и в течение первых 3 месяцев лечения модифицирующими заболевание противоревматическими препаратами (DMARD). У участников контрольной группы не было заболеваний суставов или воспалительного артрита в анамнезе (и не было затронутых родственников первой степени родства). В число контрольных лиц входили коллеги из Университета Лидса (например, ученые, административные работники, сотрудники лабораторий, уборщицы) и люди из местного сообщества (например, непрофессиональные члены группы пациентов и общественности Центра биомедицинских исследований Лидса, их контакты и местные общественные группы).Участники контрольной группы были типичными для населения в целом с рядом представленных социально-экономических групп.
Демографические данные и анализ сывороточного IgG анти-CCP2 (Immunocap; Phadia) были взяты во время оценки пародонта.
Пародонтологическое обследование было выполнено в больнице Чапел Аллертон, Лидс. Состояние пародонта оценивали 3 опытных стоматолога (V.C., A.S. и A.T.). Стоматологи не знали о статусе РА участников.Каждому участнику было проведено полное обследование 6 участков на каждом естественном зубе (записанное в виде 6-балльной карманной таблицы). Шесть измеренных участков представляли собой 4 угла зуба и среднюю точку между щечной и лингвальной сторонами зуба. Следующие параметры были записаны на каждом доступном стоматологическом участке: глубина зондирующего кармана (PPD) (миллиметры), клинический уровень прикрепления (CAL) (миллиметры) и наличие кровотечения при зондировании (BOP) (указано как присутствует или отсутствует). Пародонтальный зонд PCP10 (Hu-Friedy) использовался для оценки BOP и PPD.Измерения PPD проводились вдоль вертикальной оси зуба на каждом участке с использованием силы приблизительно 0,25 Н.
локализации заболеваний пародонта были определены в соответствии с недавним обновлением Классификации заболеваний и состояний пародонта Американской академии пародонтологии 1999 года. 16 Для обеспечения высокой чувствительности пороговые значения для CAL и PPD были намеренно установлены таким образом, чтобы охватить все участки с легким, средним и тяжелым пародонтитом. Участки пародонта с CAL 2 мм или более и PPD 4 мм или более были определены как участки пародонтита (PDD) и считаются местами текущего или прошедшего (включая лечившегося) пародонтита.Участки пародонта с CAL 2 мм или более, PPD 4 мм или более и BOP были определены как активные PDD и считаются отражающими текущий активный периодонтит.
В дополнение к этим параметрам стоматологи также классифицировали всех участников в соответствии с общим клиническим состоянием пародонта. Медицинская карта пародонта каждого участника была просмотрена 3 стоматологами, которые не знали всех подробностей о пациенте. В каждом случае клинический статус пародонта согласовывался на основе консенсуса и классифицировался следующим образом: (1) здоровый (без пародонтита или гингивита), (2) только гингивит (без пародонтита) или (3) пародонтит с гингивитом или без него.Классификация была основана на клинической оценке и обновлении Классификации заболеваний и состояний пародонта Американской академии пародонтологии 1999 г., 16 , с учетом распределения, степени и тяжести пародонтита, а также необходимости лечения.
Площадь воспаления пародонта
Для количественной оценки общего бремени воспаления пародонта для каждого участника была рассчитана общая площадь воспаленной поверхности пародонта (PISA) на основе измерений PPD и CAL на каждом стоматологическом участке с использованием метода, описанного Nesse et al. 17 Этот индекс был предложен как способ более точной количественной оценки воспаленных тканей пародонта. 17
Оценка ультразвукового исследования
Ультрасонографическое исследование (УЗИ) проводилось у всех лиц из группы риска CCP + двумя опытными сонографами опорно-двигательного аппарата (J.L.N. и L.ЧАС.). Использовался стандартизированный протокол США с 38 соединениями (полная информация приведена в приложении 1 в приложении). Сканирование выполняли с использованием машины Logiq E9 (General Electric) с использованием датчика 15–6 МГц. Сигнал Power Doppler (PD) оценивался с использованием частоты повторения импульсов, установленной от 0,7 до 1,0 кГц, фильтра средней стенки и регулировки усиления до подавления фонового шума. Доплеровская частота составляла 10 МГц. Оценка по шкале серого и синовита БП проводилась в соответствии с системой оценки результатов оценки исходов Европейской лиги против ревматизма в ревматологии. 18 , 19
Сбор поддесневого налета
Здоровые и больные участки пародонта, подходящие для сбора поддесневого налета, были идентифицированы стоматологами во время пародонтологического осмотра. Наддесневой налет был удален с помощью ватных тампонов перед взятием образца (eAppendix 2 в Приложении).
Извлечение ДНК, подготовка библиотеки и секвенирование
Образцы поддесневого налета оттаивали на льду от −80 ° C. Все образцы пораженных участков были объединены, и все образцы здоровых участков были объединены для каждого участника. Мы экстрагировали ДНК из объединенных образцов с помощью набора для выделения микробной ДНК UltraClean (Qiagen) в соответствии с инструкциями производителя и количественно оценили с помощью реагента и наборов дцДНК PicoGreen (Thermo Fisher Scientific) (приложение 2 в приложении).
ДНК разрезали до 200 пар оснований (п.о.) в небольшом стеклянном флаконе (microTUBE AFA Fiber Snap-Cap 6 × 16 мм) с использованием сфокусированного ультразвукового аппарата S220 (Covaris). Распределение по размеру образцов, разбавленных в 4 раза, оценивали на Agilent 2200 TapeStation, управляемом программным обеспечением Agilent 2200 TapeStation Software A.01.05, с использованием ленты Agilent High Sensitivity D1000 ScreenTape и реагентов.
В зависимости от концентрации разрезанной ДНК в образцах для создания библиотеки, включая подготовку концов, лигирование адаптера и сборку адаптеров, использовали набор для подготовки библиотеки ДНК NEBNext Ultra для Illumina или набор для подготовки библиотеки ДНК NEBNext Ultra II для Illumina (New England Biolabs). обогащение полимеразной цепной реакцией.Гранулы AxyPrep Mag PCR Clean-up (Corning) использовались на этапах очистки во время и после подготовки библиотеки для удаления не включенных адаптеров, праймеров, димеров адаптеров, димеров праймеров и других загрязнителей. Распределение по размерам и количество библиотек ДНК проверяли описанным методом. Мы объединили библиотеки ДНК, помеченные разными индексными праймерами, и секвенировали парные концы на машине Hiseq 3000 (Illumina).
Обработка метагеномных данных дробовиком
Данные последовательности были загружены в конвейер метагеномного анализа MG-RAST (версия 4.03) для качественной обработки и базового таксономического анализа. 20 Области низкого качества (базы с оценкой качества <15) и чтения короче 15 п.н. были отброшены. Искусственные реплицируемые последовательности и специфичные для хозяина видовые последовательности (например, растения, человека или мыши) также удалялись. Профили таксономической численности на уровне видов были сгенерированы путем аннотации к базе данных RefSeq, размещенной в MG-RAST с порогом 95% идентичности 21 , с использованием стратегии репрезентативного попадания. Профили численности для P gingivalis, A actinomycetemcomitans, и контрольного вида, Filifactor alocis , были отобраны и извлечены для анализа.Мы выбрали F alocis , потому что это пародонтальный патоген без известной способности индуцировать цитруллинирование.
Описательная статистика использовалась для анализа демографических и пародонтальных характеристик. Для непрерывных данных были представлены медиана и межквартильный размах (IQR), а также использовались тесты Краскела-Уоллиса для сравнения демографических и пародонтальных параметров (включая PISA) между группами участников. Когда были обнаружены существенные различия для пародонтального параметра, затем проводилось апостериорное тестирование с использованием коррекции Бонферрони с тестом Данна.Для категориальных данных (т. Е. Клинической пародонтальной классификации) для сравнения групп участников использовался критерий χ 2 или точный критерий Фишера, если это необходимо. Уровень статистической значимости был установлен на 0,05 с использованием двусторонних тестов. Корреляция Спирмена ρ использовалась для оценки ассоциаций.
Для анализа 3 пародонтальных патогенов исходные данные подсчета каждого вида ( P gingivalis, A actinomycetemcomitans, и F alocis ) были нормализованы и сравнивались между различными группами с использованием пакета DESeq2 (параметры: test = «Wald» и fitType = «параметрический») в статистической программе R версии 3.5.1 (Проект R для статистических вычислений). 22 P значения были скорректированы для множественного тестирования с использованием коррекции частоты ложных обнаружений. Псевдосчет 0,5 был добавлен к нормализованному счету для построения графика в логарифмическом масштабе. Размеры эффекта и стандартные ошибки рассчитывались с помощью DESeq2 на основе отрицательного биномиального (гамма-Пуассоновского) распределения.
Сорок восемь CCP + лиц из группы риска (средний [SD] возраст 51.9 [11,4] лет; 31 [65%] женщина), 26 пациентов с ERA (средний [SD] возраст, 54,4 [16,7] года; 14 [54%] женщин) и 32 здоровых человека (средний [SD] возраст, 49,4 [15,3] года; 19 [59%] женщин) были включены. Группы были сбалансированы по возрасту, полу и статусу курения (таблица 1). Из 26 пациентов с ERA 10 (38%) не получали БПВП. Все пациенты с ERA, которые начали терапию DMARD, получали монотерапию со средней продолжительностью всего 2 недели; 1 пациент начал принимать сульфасалазин, а остальные — метотрексат.Ни один из лиц из группы риска CCP + или здоровых людей не получал БПВП.
Все лица из группы риска CCP + и пациенты с ERA дали положительный результат на сывороточные IgG-антитела к CCP2 с использованием набора Bioplex 2200 (BioRad) (титр ≥3 × верхний предел нормального диапазона), когда они были задействованы в исследовании. Из этих 83 участников у 5 (6%) был отрицательный результат анализа сывороточного IgG анти-CCP2 с использованием набора Immunocap (Phadia) (таблица 1) во время оценки пародонта.
Процент участков пародонта с CAL 2 мм или больше, PPD 4 мм или больше, BOP, PDD и активным PDD был все больше у людей из группы риска анти-CCP + по сравнению со здоровыми людьми (Таблица 2).Напротив, не было различий ни по одному из этих параметров между людьми из группы риска, принимающими анти-CCP +, и пациентами с ERA. Количество отсутствующих зубов было выше у пациентов с ERA по сравнению со здоровыми людьми, что, вероятно, отражает более высокий средний возраст в этой группе (54 и 49 лет соответственно).
Общий клинический статус пародонта у всех участников показан в таблице 3. Стоматологи классифицировали 35 из 48 лиц из группы риска CCP + (73%) как страдающих пародонтитом, по сравнению с 12 из 32 здоровых людей (38%) (разница 35%; 95 % ДИ, 13% -53%; P =.02). Медиана (межквартильный размах) процент пораженных участков пародонта была выше у лиц из группы риска CCP + по сравнению со здоровыми людьми (3,3% [0–11,3%] против 0% [0–0,7%]). Частота пародонтита не показала разницы в распространенности между участниками группы риска CCP + и пациентами с ERA (1,1% [0% -13,1%]) (разница, 19%; 95% ДИ, от -3% до 40%; P = 0,10).
Площадь воспаления пародонта
Медиана (IQR) PISA у лиц из группы риска CCP + составила 221 мм 2 (81-504 мм 2 ) по сравнению с 40 мм 2 (12-205 мм 2 ) у здоровых людей и 116 мм 2 (25-269 мм 2 ) у пациентов с ERA ( P =.006; Тест Краскала-Уоллиса), указывающий на более высокое общее воспаление пародонта у лиц из группы риска CCP + по сравнению со здоровыми участниками ( P = 0,002) (см. Рисунок в приложении).
Ультрасонографическая оценка
Все лица, входящие в группу риска CCP +, прошли обследование в США. Синовит определялся как наличие синовиальной гипертрофии по серой шкале, превышающей или равной 1, и сигнала PD больше или равного 1 (серая шкала ≥1 и PD ≥1) в одном и том же суставе.Из 48 индивидуумов группы риска CCP + 46 (96%) не имели синовита УЗИ, что свидетельствует об отсутствии как клинического, так и субклинического воспаления суставов у этих субъектов. Из 2 пациентов с синовитом УЗИ, у 1 был синовит обоих первых плюснефаланговых суставов, а у другого — обоих лучезапястных суставов.
Три патогена пародонта, выбранные из метагеномов дробовика
Обилие P gingivalis , A actinomycetemcomitans, и F alocis в здоровых и пораженных участках пародонта сравнивали в соответствии со статусом RA.Счетчики считывания P gingivalis , A actinomycetemcomitans, и F alocis были получены из MG-RAST (база данных RefSeq с 95% идентичностью) и нормализованы с помощью DESeq2. На здоровых участках пародонта было больше P gingivalis у лиц из группы риска CCP + по сравнению со здоровыми участниками (величина эффекта = 3,00; 95% ДИ 1,71-4,29; P <0,001 [тест Вальда]). и пациенты с ERA (размер эффекта = 2,14; 95% ДИ 0,77–3,52; P =.002 [тест Вальда]) (рисунок). Интересно отметить, что на пораженных участках пародонта как CCP + из группы риска, так и здоровые участники имели большее количество P gingivalis по сравнению с пациентами с ERA (размер эффекта = 5,12; 95% ДИ, 3,34-6,90 и 4,60; 95% ДИ, 2,54 -6,66; P <0,001 соответственно). Не было различий в количестве A actinomycetemcomitans или F alocis в зависимости от статуса RA ни в здоровых, ни в пораженных участках пародонта.
В этом предварительном поперечном исследовании мы выявили повышенную распространенность заболеваний пародонта и воспаления пародонта у лиц из группы риска CCP + без воспаления суставов.Кроме того, мы выявили повышенную численность пародонтопатической бактерии P gingivalis на здоровых участках пародонта у участников группы риска CCP + по сравнению с контрольными людьми и пациентами с ERA.
Несколько обсервационных исследований 7 , 8,23 -30 и недавний метаанализ 6 подтвердили связь между пародонтозом и установленным РА. Однако невозможно оценить, действительно ли пародонтоз является триггером воспалительного артрита у пациентов, у которых уже развился РА.В текущем исследовании мы выполнили комплексное обследование пародонта, используя количественное измерение пародонта, общий клинический статус пародонта и общую воспалительную нагрузку пародонта (по PISA) у участников группы риска с антителами против CCP, но без клинического или субклинического синовита. Мы обнаружили повышенную распространенность очагов заболеваний пародонта и общего клинического периодонтита, а также увеличение PISA у лиц из группы риска CCP + по сравнению с контрольными лицами, соответствующими по возрасту и статусу курения.Присутствие сывороточного ACPA с высоким титром у этих лиц указывает на нарушение толерантности и развитие системного аутоиммунитета, связанного с РА. Перспективные данные когорты группы риска CCP + предполагают, что, хотя не все эти люди могут считаться пре-РА, у некоторых из них будут развиваться клинические артриты и РА. 15 Это говорит о том, что воспаление пародонта может предшествовать воспалению суставов в развитии РА, и поддерживает концепцию пародонта как участка слизистой оболочки, вызывающего заболевание.Эти результаты согласуются с недавним исследованием 31 , показывающим более высокую частоту и большую тяжесть заболеваний пародонта у родственников первой степени родства пациентов с РА, хотя в этом исследовании только 9% родственников первой степени родства с пародонтитом были против КПК положительный.
Микробиом при пародонтозе отличается от микробиома пародонта с повышенным обилием патогенных бактериальных сообществ. 32 , 33 Porphyromonas gingivalis — ключевой компонент так называемого красного комплекса грамотрицательных бактерий, вызывающих заболевания пародонта. 9 Было высказано предположение, что P gingivalis посредством посттрансляционного цитруллинирования белков слизистой оболочки пародонта может обеспечивать антигенный источник ACPA при RA. 11 Недавнее исследование 34 показало, что пероральное праймирование с использованием P gingivalis может вызвать эрозивный ACPA-позитивный артрит на животной модели in vivo. В текущем исследовании мы обнаружили повышенное содержание P gingivalis в поддесневой бляшке из здоровых участков пародонта у участников группы риска CCP + по сравнению со здоровыми людьми и пациентами с ERA.Эта связь не наблюдалась на пораженных участках пародонта, где P gingivalis был идентифицирован на аналогичных уровнях у CCP + группы риска и здоровых участников. Причина более низкого содержания P gingivalis в пораженных участках у пациентов с ERA по сравнению с другими группами до конца не ясна, но это может быть связано с ранним эффектом терапии; 62% этих пациентов получали БПВП, большинство также получали кортикостероиды. Возможно, что эти методы лечения могли оказать раннее влияние на микробиом пародонта.Поскольку пародонтит может быть вызван дисрегулируемой воспалительной реакцией, инициированной биопленкой, возможно, что иммуномодулирующая терапия может иметь прямое влияние на воспаление пародонта с последующим воздействием на микробиом. Также считается, что DMARD обладают противомикробными свойствами. 35 -37 Возможно, это может повлиять на P gingivalis , и это будет интересная область для изучения в будущей работе.
Интересно, что недавнее исследование обнаружило доказательства дисбактериоза поддесневого микробиома у пародонтально здоровых пациентов с РА по сравнению с контрольной группой, предполагая, что РА может быть связан с изменениями в микробиоме пародонта независимо от воспаления пародонта. 38 Содержание P gingivalis не различается между группами в этом исследовании, чего можно ожидать, поскольку у пациентов не было пародонтита. Напротив, в текущем исследовании P gingivalis был обогащен в пародонтально здоровых участках группы риска CCP +, у большинства из которых также были участки пародонтоза. Возможно, что дисбактериоз, связанный с пародонтитом, имеет более широкий эффект, особенно у лиц из группы риска CCP +, что приводит к дисбактериозу на удаленных здоровых участках пародонта.Следует отметить, что эта связь не наблюдалась для A actinomycetemcomitans или F alocis, , что позволяет предположить, что P gingivalis может быть особенно значимым при CCP + в группе риска. Хотя было показано, что A actinomycetemcomitans способен к цитруллинированию, 12 он особенно связан с агрессивными формами пародонтита, которые не наблюдались у наших участников. 39
Это исследование ограничено относительно небольшим размером выборки; Лица из группы риска CCP + трудно идентифицировать, и наши пациенты были набраны на основе национального исследования первичной медико-санитарной помощи.Из-за совпадения частот в период набора окончательные номера групп были неодинаковыми; несмотря на превышение запланированного количества участников, в здоровую контрольную группу и группу ERA было идентифицировано и набрано меньше пациентов по сравнению с группой риска CCP +. Некоторые люди из всех групп отказались от участия в исследовании. К сожалению, подробные сведения об участниках, допущенных к участию, которые отказались от участия в каждой группе, недоступны. Возможно, этот самостоятельный выбор привел к смещению.Однако опрос участников, проведенный до оценки пародонта, показал отсутствие различий в доступе к стоматологической помощи или о самопровозглашенных симптомах со стороны полости рта между группами риска и здоровыми контрольными группами (eAppendix 3 и eTable in the Supplement). Хотя группы участников были сопоставлены по статусу курения, мы не подошли для диабета, который также связан с пародонтозом. Однако распространенность диабета у наших участников была низкой и вряд ли повлияла на данные (приложение 4 в Приложении).Мы признаем, что другие редкие системные состояния связаны с заболеваниями пародонта (например, нейтрофильные нарушения, буллезный эпидермолиз, синдром Элерса-Данлоса, гематологические злокачественные новообразования). 40 Мы не знали о том, что наши участники были затронуты этими условиями, но они не были специально исключены. Эти ограничения означают, что результаты этого исследования следует рассматривать как предварительные. Эти данные должны быть подтверждены в других когортах, и длительное последующее наблюдение будет важно для оценки того, может ли пародонтоз прогнозировать начало клинического артрита у лиц из группы риска CCP +.
Это исследование является первым, насколько нам известно, продемонстрировавшим повышенную распространенность заболеваний пародонта вместе с повышенным содержанием P gingivalis у анти-CCP-позитивных лиц с риском РА. Эти данные предполагают, что воспаление пародонта и обогащение P gingivalis может предшествовать воспалению суставов при РА и поддерживать связь между этими факторами риска и началом заболевания. Это исследование дополняет появляющуюся базу данных, связывающую пародонтальные и системные заболевания, и, следовательно, дополнительно подчеркивает потенциальную важность улучшения здоровья зубов и снижения бремени заболеваний пародонта для риска хронических системных заболеваний, таких как РА.Важно отметить, что эти результаты показывают, что воспаление пародонта может быть законной целью для профилактического вмешательства при РА.
Принято к публикации: 18 апреля 2019 г.
Опубликовано: 7 июня 2019 г. doi: 10.1001 / jamanetworkopen.2019.5394
Открытый доступ: Это статья в открытом доступе, распространяемая в соответствии с условиями CC -По лицензии. © 2019 Mankia K et al. Открытая сеть JAMA .
Автор для переписки: Пол Эмери, MD, FRCP, Институт ревматической и костно-мышечной медицины Лидса, больница Чапел Аллертон, Чапелтаун-роуд, Лидс LS7 4SA, Великобритания ([email protected]).
Вклад авторов: Доктор Эмери имел полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных. Доктора Манкиа и Ченг внесли равный вклад. Доктор Эмери был главным исследователем.
Концепция и дизайн: Mankia, Cheng, Hunt, Meade, Clerehugh, Speirs, Tugnait, Hensor, Devine, Emery.
Сбор, анализ или интерпретация данных: Манкия, Ченг, До, Мид, Канг, Клерхью, Спейрс, Тугнаит, Хенсор, Нам, Девайн.
Составление рукописи: Манкия, Ченг, До, Канг, Клерху, Тугнаит, Девайн, Эмери.
Критический пересмотр рукописи для важного интеллектуального содержания: Mankia, Cheng, Hunt, Meade, Clerehugh, Speirs, Tugnait, Hensor, Nam.
Статистический анализ: Mankia, Cheng, Kang, Hensor.
Получено финансирование: Эмери.
Административная, техническая или материальная поддержка: Cheng, Do, Hunt, Meade, Clerehugh, Tugnait, Devine, Emery.
Надзор: До, Хант, Девайн, Эмери.
Раскрытие информации о конфликте интересов: Д-р Манкиа сообщил о грантах от Национального института медицинских исследований (NIHR) Лидского отдела биомедицинских исследований и о грантах от Биомедицинского исследовательского центра Лидса во время проведения исследования.Доктор Тугнайт сообщил о грантах Центра биомедицинских исследований Лидса во время проведения исследования. Д-р Хенсор сообщил о грантах от NIHR во время проведения исследования и грантах от Arthritis Research UK за пределами представленной работы. Доктор Дивайн сообщил о грантах от NIHR, Китайского совета по стипендиям и Wellcome Trust во время проведения исследования; и гранты от Colgate Palmolive Inc и Glaxo SmithKline, а также гранты и личные гонорары от ADM Protexin Ltd помимо представленных работ.Д-р Эмери сообщил о грантах и личных гонорарах от Pfizer, Merck Sharp & Dohme, AbbVie, Bristol-Myers Squibb, Roche, Samsung, Sandoz и Eli Lilly and Company; и личные гонорары от Novartis и UCB помимо представленных работ. О других раскрытиях информации не сообщалось.
Финансирование / поддержка: Это исследование было поддержано инфраструктурой NIHR в Лидсе.
Роль спонсора / спонсора: NIHR не участвовал в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Заявление об ограничении ответственности: Выраженные взгляды принадлежат авторам, а не обязательно Национальной службы здравоохранения, NIHR или Департамента здравоохранения и социального обеспечения.
Дополнительные вклады: Лаура Хортон (Центр биомедицинских исследований NIHR в Лидсе, Лидс, Великобритания) провела некоторые ультразвуковые исследования, а Летисия Гарсия Монтойя, доктор медицины (Институт ревматической и костно-мышечной медицины Лидса, Университет Лидса), помогла с некоторыми из них. анализ данных.Дайан Корскадден и Кэти Мбара (Институт ревматической и костно-мышечной медицины Лидса, Университет Лидса) и Шабнум Рашид, бакалавр наук (оральная биология, Стоматологический институт Лидса), оказали лабораторную поддержку; Ашна Чавда (DentCRU, Стоматологический институт Лидса, Университет Лидса) оказывала медсестринскую поддержку; Иэн Уэзерилл, Крис Брукс, Джиавен Доу и Филип Люксфорд (Институт ревматической и костно-мышечной медицины Лидса, Университет Лидса) оказали административную поддержку. Эти люди не получили компенсации за их роль в этой работе.
1.Нелен ММ, ван Шаарденбург D, Reesink HW, и другие. Специфические аутоантитела предшествуют симптомам ревматоидного артрита: исследование серийных измерений у доноров крови. Rheum артрита . 2004; 50 (2): 380-386. DOI: 10.1002 / art.20018PubMedGoogle ScholarCrossref 2.Brink М, Ханссон М., Матссон L, и другие. Мультиплексный анализ антител против цитруллинированных пептидов у лиц до развития ревматоидного артрита. Rheum артрита . 2013; 65 (4): 899-910. DOI: 10.1002 / art.37835PubMedGoogle ScholarCrossref 4.Barra L, Scinocca М., Сондерс S, и другие. Антитела к цитруллинированному белку у здоровых родственников первой степени родства пациентов с ревматоидным артритом. Rheum артрита . 2013; 65 (6): 1439-1447. doi: 10.1002 / art.37911PubMedGoogle ScholarCrossref 5.Ärlestig L, Муллазехи М, Кокконен H, Rocklöv J, Рённелид Дж., Дальквист SR.Антитела против циклических цитруллинированных пептидов изотипов IgG, IgA и IgM и ревматоидного фактора изотипов IgM и IgA повышены у здоровых членов семей с множественным ревматоидным артритом из северной Швеции. Энн Рум Дис . 2012; 71 (6): 825-829. DOI: 10.1136 / annrheumdis-2011-200668PubMedGoogle ScholarCrossref 8. Родригес-Лозано B, Гонсалес-Феблес Дж., Гарнье-Родригес JL, и другие. Связь между тяжестью пародонтита и клинической активностью у пациентов с ревматоидным артритом: исследование случай-контроль. Arthritis Res Ther . 2019; 21 (1): 27. DOI: 10.1186 / s13075-019-1808-zPubMedGoogle ScholarCrossref 10.McGraw WT, Potempa J, Фарли D, Трэвис J. Очистка, характеристика и анализ последовательности потенциального фактора вирулентности из Porphyromonas gingivalis , пептидиларгининдезиминазы. Заражение иммунной . 1999; 67 (7): 3248-3256.PubMedGoogle Scholar11.Rosenstein ЭД, Гринвальд Р.А., Кушнер LJ, Weissmann ГРАММ.Гипотеза: гуморальный иммунный ответ на бактерии полости рта является стимулом для развития ревматоидного артрита. Воспаление . 2004; 28 (6): 311-318. DOI: 10.1007 / s10753-004-6641-zPubMedGoogle ScholarCrossref 13. фон Эльм Э, Альтман Д.Г., Эггер М, Покок SJ, Gøtzsche ПК, Vandenbroucke JP; Инициатива STROBE. Заявление «Усиление отчетности по наблюдательным исследованиям в эпидемиологии» (STROBE): руководство по составлению отчетов по наблюдательным исследованиям. Ланцет . 2007; 370 (9596): 1453-1457. DOI: 10.1016 / S0140-6736 (07) 61602-XPubMedGoogle ScholarCrossref 15.Rakieh C, Nam JL, Хант L, и другие. Прогнозирование развития клинического артрита у лиц, положительных по анти-CCP, с неспецифическими скелетно-мышечными симптомами: проспективное наблюдательное когортное исследование. Энн Рум Дис . 2015; 74 (9): 1659-1666. doi: 10.1136 / annrheumdis-2014-205227PubMedGoogle ScholarCrossref 16. Целевая группа Американской академии пародонтологии по обновлению классификации заболеваний и состояний пародонта.Отчет рабочей группы Американской академии пародонтологии об обновлении Классификации заболеваний и состояний пародонта 1999 г. Дж Периодонтол . 2015; 86 (7): 835-838. doi: 10.1902 / jop.2015.157001PubMedGoogle ScholarCrossref 18.D’Agostino М.А., Терслев L, Aegerter П, и другие. Оценка ультразвукового синовита при ревматоидном артрите: рабочая группа по ультразвуковому обследованию EULAR-OMERACT — часть 1: определение и разработка стандартизированной системы оценки на основе консенсуса. RMD Открыть .2017; 3 (1): e000428. DOI: 10.1136 / rmdopen-2016-000428PubMedGoogle ScholarCrossref 19.Терслев L, Наредо E, Aegerter П, и другие. Оценка ультразвукового синовита при ревматоидном артрите: рабочая группа по УЗИ EULAR-OMERACT — часть 2: надежность и применение к множеству суставов стандартизированной системы оценки на основе консенсуса. RMD Открыть . 2017; 3 (1): e000427. DOI: 10.1136 / rmdopen-2016-000427PubMedGoogle ScholarCrossref 21.Pruitt К.Д., Татусова Т, Маглотт DR.Контрольные последовательности NCBI (RefSeq): тщательно подобранная база данных неизбыточных последовательностей геномов, транскриптов и белков. Nucleic Acids Res . 2007; 35 (выпуск базы данных): D61-D65. DOI: 10.1093 / nar / gkl842PubMedGoogle ScholarCrossref 24.Choi ИА, Ким JH, Ким YM, и другие. Пародонтит связан с ревматоидным артритом: исследование с участием давних пациентов с ревматоидным артритом в Корее. Korean J Intern Med . 2016; 31 (5): 977-986. DOI: 10.3904 / kjim.2015.202PubMedGoogle ScholarCrossref 26.Kässer UR, Gleissner C, Дене F, Мишель A, Willershausen-Zönnchen B, Болтен WW. Риск заболеваний пародонта у пациентов с хроническим ревматоидным артритом. Rheum артрита . 1997; 40 (12): 2248-2251. DOI: 10.1002 / art.1780401221PubMedGoogle ScholarCrossref 31.Bello-Gualtero JM, Lafaurie GI, Hoyos LX, и другие. Заболевания пародонта у лиц с генетическим риском развития артрита и раннего ревматоидного артрита: поперечное исследование. Дж Периодонтол . 2016; 87 (4): 346-356. DOI: 10.1902 / jop.2015.150455PubMedGoogle ScholarCrossref 32.Diaz П.И., Хоар А, Хонг ОТ. Изменения поддесневого микробиома и динамика сообществ при заболеваниях пародонта. Дж. Калифорния Дент Ассос . 2016; 44 (7): 421-435.PubMedGoogle Scholar35.Pretorius E, Акередолу OO, Сома П, Келл БД. Основное участие бактериальных компонентов в ревматоидном артрите и сопровождающем его окислительном стрессе, системном воспалении и гиперкоагуляции. Exp Biol Med (Maywood) . 2017; 242 (4): 355-373. DOI: 10.1177 / 1535370216681549PubMedGoogle ScholarCrossref 36.Kruszewska H, Зареба Т, Тыски S. Противомикробная активность отдельных неантибиотиков — активность метотрексата против штаммов Staphylococcus aureus . Акта Пол Фарм . 2000; 57 (доп.): 117-119.PubMedGoogle Scholar38.Lopez-Oliva Я, Паропкари AD, Сарасват S, и другие. Дисбиотические поддесневые микробные сообщества у пародонтально здоровых пациентов с ревматоидным артритом. Ревматический артрит . 2018; 70 (7): 1008-1013. DOI: 10.1002 / art.40485PubMedGoogle ScholarCrossref 40.Albandar JM, Susin C, Хьюз FJ. Проявления системных заболеваний и состояний, влияющих на пародонтальный пародонтальный аппарат: определения случаев и диагностические соображения. Дж Клин Периодонтол . 2018; 45 (приложение 20): S171-S189. DOI: 10.1111 / jcpe.12947PubMedGoogle ScholarCrossref .
 pdf
pdf The use of probiotic strains in caries prevention: a systematic review. Nutrients. 2013 ;5:2530-50. https://www.ncbi.nlm.nih.gov/pubmed/23857225
The use of probiotic strains in caries prevention: a systematic review. Nutrients. 2013 ;5:2530-50. https://www.ncbi.nlm.nih.gov/pubmed/23857225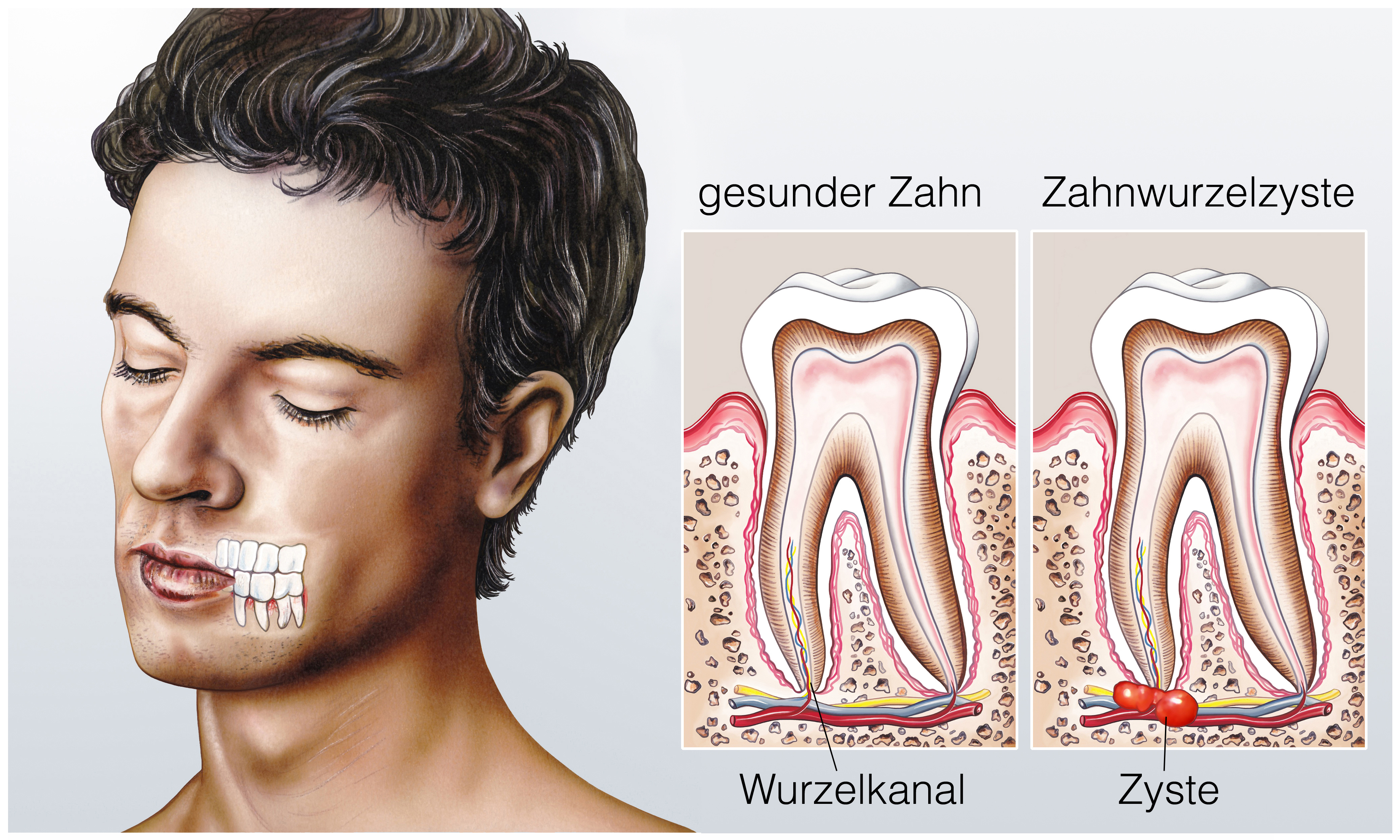 Она может иметь четыре степени: зуб отклоняется в разных направлениях не более чем на 1 мм; зуб отклоняется больше чем на 1 мм; зуб шатается во всех направлениях, в том числе и вертикальном, при отсутствии соседних зубов может быть наклонен; и зуб можно повернуть вокруг своей оси.
Она может иметь четыре степени: зуб отклоняется в разных направлениях не более чем на 1 мм; зуб отклоняется больше чем на 1 мм; зуб шатается во всех направлениях, в том числе и вертикальном, при отсутствии соседних зубов может быть наклонен; и зуб можно повернуть вокруг своей оси.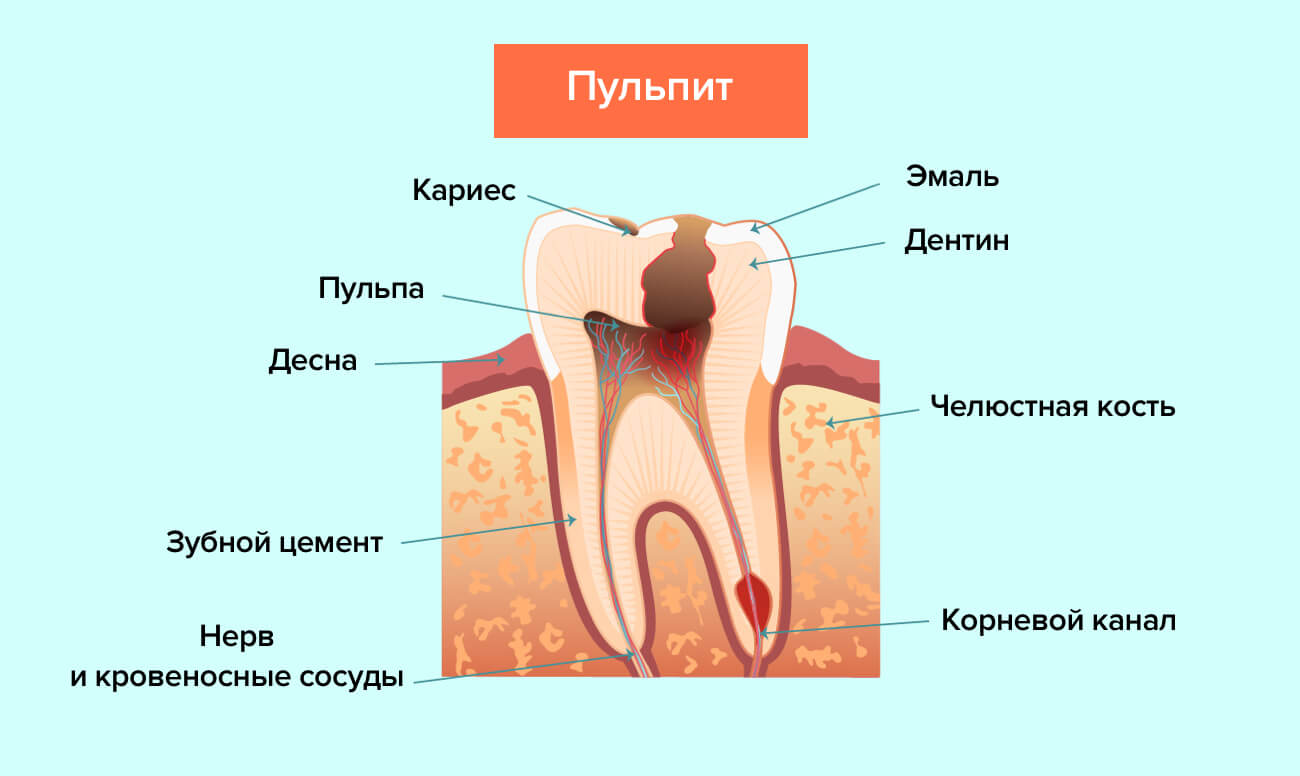 Высота межзубных перегородок уменьшается до 1/2 их длины, а глубина пародонтального кармана доходит до 5 мм
Высота межзубных перегородок уменьшается до 1/2 их длины, а глубина пародонтального кармана доходит до 5 мм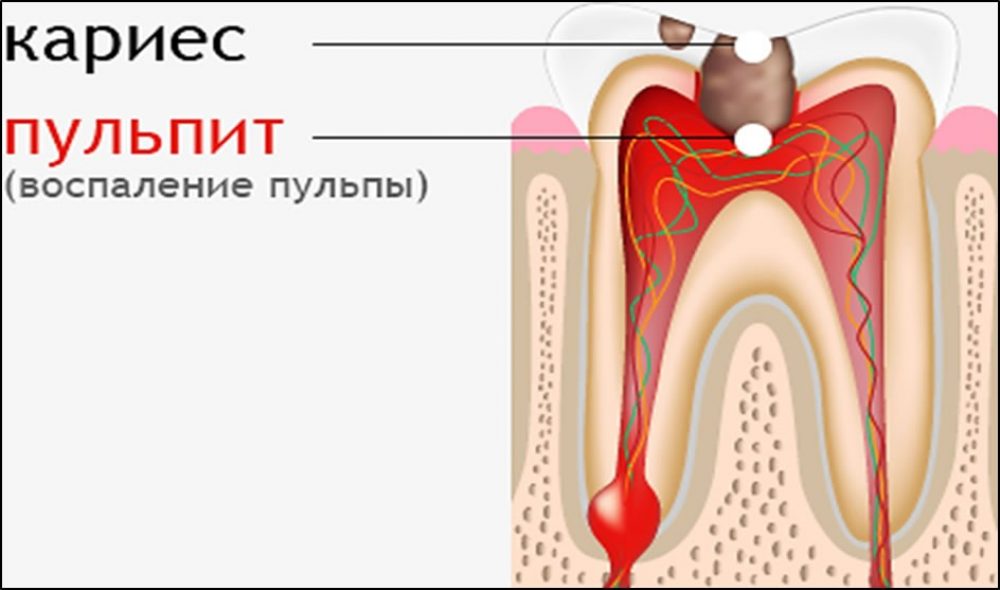 Указано в соответствии с возрастом
Указано в соответствии с возрастом